-
下列有关化学用语表示正确的是
A.甲酸甲酯的实验式:CH2O
B.钠离子的结构示意图:
C.中子数为53、质子数为78的碘原子:
D.二氧化碳分子的电子式:
难度: 简单查看答案及解析
-
下列说法与“绿色思想”不符合的是
A.启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.推广使用可降解塑料及布质购物袋,以减少“白色污染”
D.目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.01 mol·L-1Ba(OH)2溶液:Al3+、NH4+、NO3-、HCO3-
B.加入甲基橙显红色的溶液:Mg2+、Fe2+、Cl-、NO3-
C.含有苯酚的溶液中:K+、NH4+、Br-、Fe3+
D.0.01mol·L-1HCl溶液:K+、Na+、I-、SO42-
难度: 简单查看答案及解析
-
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
难度: 简单查看答案及解析
-
下列各项中,理由、结论及因果关系均正确的是
选项 理由 结论
A 键能:N≡N>Cl-Cl 单质沸点:N2>Cl2
B 分子中可电离的H+个数:H2SO4>CH3COOH 酸性:H2SO4>CH3COOH
C 元素的非金属性:N>P 酸性:HNO3>H3PO4
D 氧化性:Fe3+>Cu2+ 还原性:Fe2+>Cu
难度: 简单查看答案及解析
-
下列关于各实验装置与对应现象或结论的叙述均正确的是
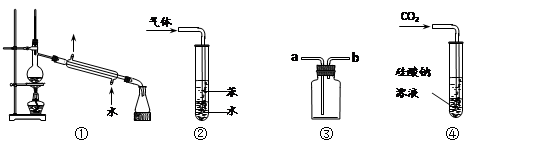
A.装置①:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.装置②:可用于吸收NH3或HCl气体,并防止倒吸
C.装置③:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3
D.装置④:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
难度: 简单查看答案及解析
-
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
甲
乙
丙
戊
①
NH3
O2
NO
H2O
②
Fe
H2O
H2
Fe2O3
③
Al2O3
NaOH溶液
Na AlO2溶液
过量CO2
④
Na2O2
CO2
O2
Na
A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
设N0表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2N0
B.常温常压下,16 g CH4中含有的原子总数为5N0
C.标准状况下,11.2 LCH3OH中含有的氢原子数目为2N0
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N0
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3+6H+ = 3H2O + 2Fe3+
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:
Ba2+ +2OH-+ NH4+ + HCO3-
NH3↑+2H2O+BaCO3↓
C.用过量冷氨水吸收SO2: SO2+NH3·H2O=HSO3-+NH4+
D.用强碱吸收工业制取硝酸尾气: NO+NO2+2OH-=2NO3-+H2O
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.对于N2(g)+3H2(g)
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应
难度: 简单查看答案及解析
-
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示。下列说法正确的是
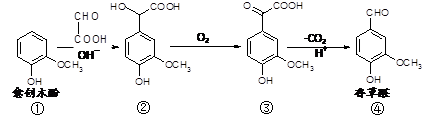
A.在上述三步反应中理论上只有①生成②的反应原子利用率为100%
B.氯化铁溶液和碳酸氢钠溶液都能鉴别①④
C.②③分子内含手性碳原子
D.在氢氧化钠溶液中,①③分别消耗NaOH物质的量之比为1 ∶2
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
A.气态氢化物的热稳定性:HnY>HnW
B.同周期元素中W的最高价氧化物对应水化物的酸性最强
C.Y和X、Z和X组成的常见化合物中化学键的类型相同
D.原子半径的大小顺序: rW>rZ>rY>rX
难度: 简单查看答案及解析
-
镍铬(Ni-Cd)可充电电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2;已知Ni(OH)2、Cd(OH)2和
NiOOH都不溶于KOH溶液。则下列有关电极反应式正确的是
A.放电时负极:Cd-2e-=Cd2+
B.放电时正极:2NiOOH + 2e- + 2H2O=2Ni(OH)2 + 2OH-
C.充电时阳极:2Ni(OH)2-2e-+ 4H+=2Ni3+ + 4H2O
D.充电时阴极:Cd(OH)2 + 2e-=Cd + 2OH-
难度: 简单查看答案及解析
-
T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s
0
2
4
6
8
n(Cl2) / mol
0
0.16
0.19
0. 20
0.20
下列说法正确的是
A.反应在前2 s 的平均速率v(CO)= 0.080mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)= 0.11 mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2 和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
难度: 简单查看答案及解析
-
下列有关溶液中微粒浓度关系的叙述正确的是
A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.向CH3COONa溶液中滴加稀HCl至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH)
D.等物质的量浓度CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-)
难度: 简单查看答案及解析