-
下列晶体中,不属于原子晶体的是
A.干冰 B.水晶 C.晶体硅 D.金刚石
难度: 中等查看答案及解析
-
某基态原子核外共有6个电子,分布在K与L电子层上,在下列L层分布中正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列关于丙烯(CH3—CH=CH2)的说法错误的是
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一平面上
难度: 中等查看答案及解析
-
下列各原子轨道中能容纳电子数最多的是
A.5p B.4f C.6s D.4d
难度: 中等查看答案及解析
-
下列有机物分子中属于手性分子的是
①乳酸[CH3CH(OH)COOH] ②2-丁醇③
④丙三醇
A.只有① B.①和② C.①②③ D.①②③④
难度: 中等查看答案及解析
-
氯化钠是日常生活中人们常用的调味品。下列性质可以证明氯化钠中一定存在离子键的是
A.具有较高的熔点 B.熔融状态能导电
C.水溶液能导电 D.常温下能溶于水
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B. V形;三角锥形
C.直线形;平面三角形 D. V形;平面三角形
难度: 中等查看答案及解析
-
下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.PCl5
难度: 中等查看答案及解析
-
下列分子或离子中键角由大到小排列顺序是
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③ B.⑤①④②③
C.④①②⑤③ D.③②④①⑤
难度: 中等查看答案及解析
-
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是
A.它是一种共价化合物
B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应
D.它受热时,不易分解
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是
A.组成单质的分子内一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定为极性键
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.气态氢化物的稳定性:HmY小于HnX
D.最高价含氧酸的酸性:X对应的酸性弱于Y对应的
难度: 中等查看答案及解析
-
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是
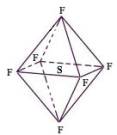
A.SF6中各原子均达到8电子稳定结构
B.SF6易燃烧生成SO2
C. SF6分子是含有极性键的非极性分子
D.SF6是原子晶体
难度: 中等查看答案及解析
-
石墨是层状晶体,每一层内碳原子排列成正六边形,一个个六边形排列成平面的网状结构。如果将每对相邻原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与碳—碳化学键数的比是
A.1∶1 B.1∶2
C.1∶3 D.2∶3
难度: 中等查看答案及解析
-
若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素位于周期表第5周期第IB族 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M层上共有8个电子
难度: 中等查看答案及解析
-
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是

A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
难度: 中等查看答案及解析
-
R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是
A.原子半径:R>Q B.R和Q可形成离子化合物
C.R和Q可形成非极性分子RQ2 D.R和Q可形成共价化合物RQ3
难度: 中等查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
难度: 中等查看答案及解析
-
下列说法中错误的是
A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同
D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b
难度: 中等查看答案及解析