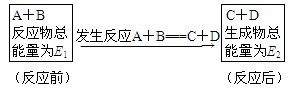-
下列物质加入水中,显著放热的是 ( )
A.固体NaCl B.生石灰 C.无水乙醇 D.固体NH4NO3
难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是( )
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就可以发生
C.反应条件是加热的反应不一定都是吸热反应
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
难度: 简单查看答案及解析
-
已知反应A+B===C+D为放热反应,对该反应的下列说法中正确的是( )
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的能量总和一定高于C和D的能量总和
D.因该反应为放热反应,故不必加热就可自动进行
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是( )
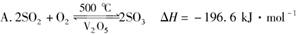
B.H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
难度: 简单查看答案及解析
-
已知1 mol NaOH与HCl完全反应放出57.4 kJ的热量。下列热化学方程式书写正确的是( )
A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+28.7 kJ/mol
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-28.7 kJ/mol
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol
难度: 简单查看答案及解析
-
已知H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)===1/2H2(g)+1/2 Cl2(g)的ΔH为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1 C.+92.3 kJ D.+92.3 kJ·mol-1
难度: 简单查看答案及解析
-
下列关于反应热的说法正确的是( )
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+1/2O2(g)===CO(g) ΔH=110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( )

A.ΔH1=ΔH2=ΔH3=ΔH4 B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4 D.ΔH1=ΔH2+ΔH3+ΔH4
难度: 简单查看答案及解析
-
下列说法中,错误的是( )
A.干冰升华要吸收大量的热,这就是化学反应中的吸热反应
B.酒精常被用作酒精灯和内燃机中的燃料,说明酒精燃烧是放热反应
C.木炭常温下不燃烧,加热才能燃烧,但木炭燃烧是放热反应
D.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量
难度: 简单查看答案及解析
-
下列说法不正确的是( )
①化石燃料在任何条件下都能充分燃烧 ②化石燃料在燃烧过程中会产生污染环境的CO、SO2等有害气体 ③直接燃烧煤不如将煤进行深加工后再燃烧效果好 ④固体煤变为气体燃料后,燃烧效率将更低
A.①② B.①③ C.①④ D.③④
难度: 简单查看答案及解析
-
下列变化为放热的化学反应的是( )
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如下图所示的化学反应

难度: 简单查看答案及解析
-
在36 g 碳不完全燃烧所得气体中,CO占
体积,CO2占
体积,且
C(s) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.172.5 kJ B. 1149 kJ C.283kJ D. 517.5 kJ
难度: 简单查看答案及解析
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol,N2(g)+O2(g)===2NO(g) ΔH=+180 kJ/mol,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ/mol B.+386 kJ/mol C.-746 kJ/mol D.+746 kJ/mol
难度: 简单查看答案及解析
-
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1①
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2②
H2O(g)===H2O(l) ΔH=-Q3③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
难度: 简单查看答案及解析