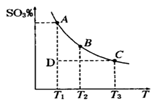
-
下列依据热化学方程式得出的结论正确的是
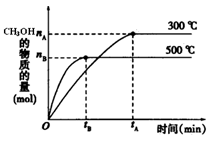
A.已知H2(g)+
O2(g)=H2O(g);△H=-241.8 kJ·mol—1,则氢气的燃烧热为241.8 kJ·m
ol—1
B.已知C(石墨,s)=C(金刚石,s); △H= +1.9 kJ·mol—1,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ· mol—1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ
D.已知2C(s)+2O2(g)=2CO2(g)) △H=a kJ·mol—1、 2C(s)+O2(g)=2CO(g) △H=b kJ· mol—1,则a>b
难度: 中等查看答案及解析
-
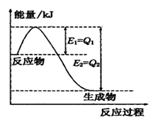
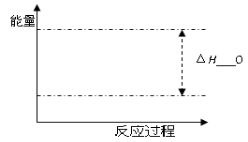
反应A(g) + B(g)
C(g) + D(g) 发生过程中的能量变化如右图,
△H 表示反应的焓变。下列说法正确的是
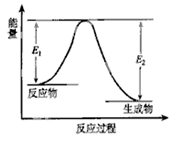
A.该反应为吸热反应
B.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
C.反应体系中加入催化剂,反应速率增大,△H不变
D.反应达到平衡时,降低温度,A的转化率减小
难度: 中等查看答案及解析
-
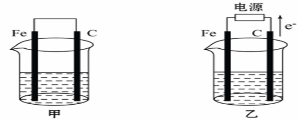
右图是模拟电化学反应的装置图。下列有关叙述中,不正确的是
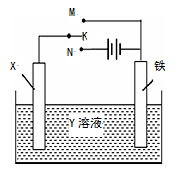
A.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
B.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度将减小
C.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中的阳离子向铁电极移动
D.X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
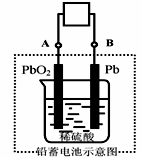
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,则下列说法正确的是:
A.放电时:电子流动方向由A到B
B.放电时:正极反应是Pb-2e-+SO42-
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O
PbO2+SO42-+4H+
难度: 中等查看答案及解析
-
下列图示中关于铜电极的连接错误的是
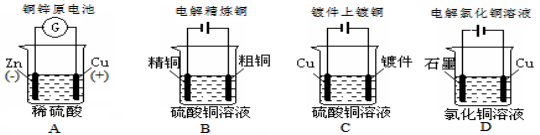
难度: 中等查看答案及解析
-
在密闭容器中,反应X2(g)+Y2(g)
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
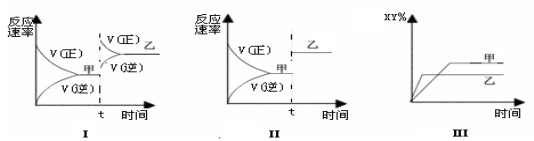
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是升高温度的变化情况 D.图Ⅲ是增大压强的变化情况
难度: 中等查看答案及解析
-
对于可逆反应: 2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是
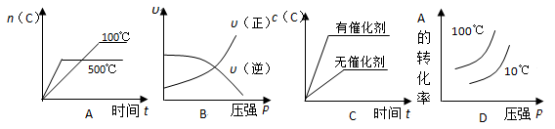
难度: 中等查看答案及解析