-
下列说法正确的是( )
A. 非金属单质中一定存在共价键
B. 金属元素和非金属元素形成的化合物一定是离子化合物
C. 含共价键的化合物不一定是共价化合物
D. 溶于水能导电的化合物就是离子化合物
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A. ②③④ B. ②③④⑤ C. ①③④ D. ①②③④
难度: 中等查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )

①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验.
A. ②③④ B. ①②④ C. ①②③ D. ①③④
难度: 中等查看答案及解析
-
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
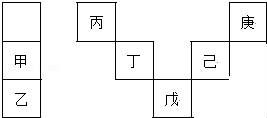
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,庚和乙形成的化合物易溶于水
D. 丁的最高价氧化物不与任何酸反应
难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是( )
A. NH4+、H+、NO3﹣、HCO3﹣ B. K+、Al3+、SO42﹣、NH3•H2O
C. Na+、K+、SO32﹣、Cl2 D. Na+、CH3COO﹣、CO32﹣、OH﹣
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)⇌xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
难度: 中等查看答案及解析
-
现有一瓶1 000 mL、含25% NaClO、密度是1.19 g.cm-3的“84消毒液”,使用时需要稀释100倍(体积比),密封保存。下列分析不正确的是
A. 该“84消毒液”中NaClO物质的量浓度为4.0 mol·L-l
B. 该“84消毒液”稀释100倍后,Na+的物质的量浓度为0. 04 mol·L-l
C. 空气中的CO2与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O= NaHCO3+ HClO
D. 用容量瓶配制上述浓度的“84消毒液”480 mL,需要称量的NaClO固体质量为143.0 g
难度: 中等查看答案及解析