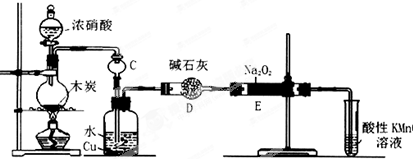
-
以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA
B.28 g CO中所含的原子数为2 NA
C.0.1 mol•L﹣1Na2CO3溶液中,含有CO32﹣数为0.1 NA
D.标准状况下,22.4 L苯的分子数为NA
难度: 简单查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用.下列分类标准合理的是
A.根据纯净物中的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
A.①②⑤ B.②④ C.②④⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2﹣、Al3+、CO32﹣、NO3﹣七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是
A.溶液中可能含有AlO2﹣
B.溶液中可能含有NO3﹣
C.溶液中一定不含Fe2+和Fe3+
D.溶液中可能含有Fe3+,但一定不含Fe2+
难度: 中等查看答案及解析
-
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液.下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明氧化性:Cr2O72﹣>I2
D.实验③证明H2O2既有氧化性又有还原性
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
难度: 中等查看答案及解析
-
如图进行实验,试管中现象对应的离子方程式不正确的是
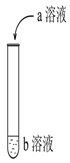
选项
a
b
试管中现象
离子方程式
A
硫酸
KI淀粉
在空气中放置一段时间后溶液呈蓝色
4H++ 4I- + O2=2I2 + 2H2O
B
稀盐酸
Na2CO3
开始时无气泡,后来有气泡
CO
+ H+ = HCO
;
HCO
+ H+ =H2O + CO2↑
C
稀盐酸
Na2SiO3
产生白色胶状物
2H++ SiO
=H2SiO3(胶体)
D
硫酸
滴有酚酞Ba(OH)2
有白色沉淀生成,溶液由红色变为无色
Ba2+ + OH- + H+ + SO
=
BaSO4↓ + H2O
难度: 困难查看答案及解析