-
乙二醇和丙三醇的有关数据见下表。则分离乙二醇和丙三醇混合液的最佳方法是
物质
分子式
熔点/℃
沸点/℃
密度/g·cm-1
溶解性
乙二醇
C2H4O2
-11.5
198
1.11
易溶于水和乙醇
丙三醇
C3H8O3
17.9
290
1.26
能跟水、酒精以任意比互溶
A. 分液 B. 蒸馏 C. 冷却至0℃后过滤 D. 加水萃取
难度: 简单查看答案及解析
-
一定含有离子的物质是
A. I2 B. CH3CH2OH C. HCl D. KCl
难度: 简单查看答案及解析
-
有关氯化钠叙述错误的是
A. 是强电解质 B. 固体能导电
C. 电子式为:
D. 25℃时,溶液的pH=7
难度: 简单查看答案及解析
-
重水(
)是重要的核工业原料,关于氘原子(
)说法错误的是
A. 氘原子核外有1个电子 B. 氘原子质量数为2
C. 一个氘原子中含有2个中子 D. 与氕原子互为同位素
难度: 简单查看答案及解析
-
Na+的浓度不是1 mol/L的溶液是
A. 0.5mol/L的NaCl B. 0.5 mol/L的Na2SO4
C. 1mol/L的NaOH D. 0.5 mol/L的Na2CO3
难度: 简单查看答案及解析
-
在含有H+、Cl-、Na+的溶液中,还可以大量共存的离子是
A. CO32- B. AlO2- C. Ca2+ D. Ag+
难度: 中等查看答案及解析
-
可以进行烘干操作的仪器是
A. 量筒 B. 锥形瓶 C. 容量瓶 D. 滴定管
难度: 简单查看答案及解析
-
按照有机物的命名规则,下列命名正确的是
A.CH2Br-CH2Br 二溴乙烷
B.CH3OOCCH3 甲酸乙酯
C.
硬脂酸甘油脂
D.
3,3-二甲基-2-丁醇
难度: 简单查看答案及解析
-
将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是
A. Al2O3 + OH- → AlO2- + H2O B. 2Al3+ + 6OH- → 2Al(OH)3↓
C. 2Al + 2OH- + 2H2O → 2AlO2- + 3H2↑ D. 2Al + 6H2O → 2Al3+ + 6OH- +3H2↑
难度: 简单查看答案及解析
-
实验现象描述错误的是
A. 碘单质受热升华:紫色蒸气 B. 硫磺在氧气中燃烧:蓝紫色的火焰
C. 铁丝在氯气中燃烧:棕褐色的烟 D. 氢气在氯气中燃烧:淡蓝色火焰
难度: 简单查看答案及解析
-
可测出某84消毒液的pH为10.2是
A. pH试纸 B. 红色石蕊试纸
C. 数字pH计 D. 以酚酞为指示剂进行酸碱中和滴定
难度: 简单查看答案及解析
-
某次硫酸铜晶体结晶水含量的测定实验中,相对误差为-2.7%,原因可能是
A. 实验时坩埚未完全干燥 B. 加热后固体颜色有少量变黑
C. 加热过程中晶体有少量溅失 D. 加热后固体未放入干燥器中冷却
难度: 中等查看答案及解析
-
除去物质中含少量杂质的方法错误是
选项
物质(括号内为杂质)
实验方法
A
K2SO4 (K2CO3)
加入稀硫酸使溶液呈中性
B
NaCl (KNO3)
样品配制成热饱和溶液,冷却结晶,过滤
C
CO2(HCl)
通过NaHCO3饱和溶液,干燥
D
溴苯(溴)
加入足量NaOH溶液,充分振荡,分液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
只用组内溶液相互混合就能鉴别的组别是
A. Na2SO4、BaCl2、KNO3、NaCl B. NaCl、AgNO3、NaNO3、HCl
C. NaOH、Na2SO4、FeCl3、MgCl2 D. Na2SO4、NaNO3、CaCl2、NaCl
难度: 中等查看答案及解析
-
能用键能大小解释的事实是
A. 稀有气体化学性质很稳定 B. 硝酸易挥发,而硫酸难挥发
C. 氮气的化学性质比氧气稳定 D. 常温常压下,溴呈液态,碘呈固态
难度: 中等查看答案及解析
-
室温下,2H2(g)+ O2(g)
2H2O(l)+ 566kJ。下列说法错误的是
A. H2→H+H的过程需要吸收热量
B. 若生成2mol水蒸气,则放出的能量大于566 kJ
C. 2g氢气完全燃烧生成液态水所释放的能量为283kJ
D. 2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
难度: 简单查看答案及解析
-
钢铁在海水中的锈蚀过程示意见右图,有关说法正确的是
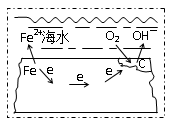
A. 电子从碳转移给铁
B. 在钢铁上连接铅块,可起到防护作用
C. 正极反应为:O2 + 2H2O + 4e →4OH-
D. 该金属腐蚀过程为析氢腐蚀
难度: 简单查看答案及解析
-
橙花醇可作为香料,其结构简式如图:

关于橙花醇叙述错误的是
A. 可使酸性 KMnO4溶液褪色
B. 橙花醇中含有2种官能团
C. 在浓硫酸催化下加热脱水,生成的产物不止一种
D. 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴
难度: 中等查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
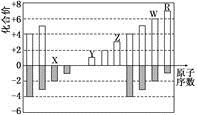
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A. 固体分解越完全,消耗盐酸的量越少
B. 共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C. 固体中碳酸氢钠含量越多,钠元素的含量也越多
D. 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
难度: 中等查看答案及解析



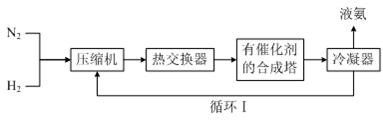


 。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。
。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。 )
)