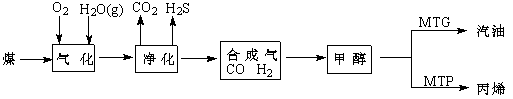
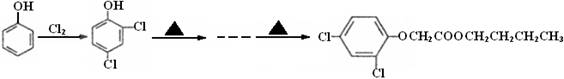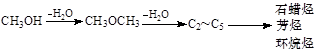-
中央电视台报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。向排毒盆内倒入了纯净的温水,双脚放入盆中,启动电源开关,加入了适量精盐。过一段时间,盆中开始出现绿色、红褐色的絮状物。下列说法正确的是
A.此“排毒基强离子排毒仪”一定是用惰性电极制成的
B.加一些精盐的主要目的是起到消炎杀菌的作用
C.绿色、红褐色的絮状物就是从脚底排出的体内毒素
D.绿色、红褐色的絮状物是氢氧化亚铁、氢氧化铁形成的混合物
难度: 简单查看答案及解析
-
下列有关化学用语的表达正确的是
A.甲醛的电子式:
B.
的名称:3―甲基―2―丁烯
C.含78个中子的碘的放射性核素:
D.纯碱溶液呈碱性的原理:CO32-+2H2O=H2CO3+2OH-
难度: 简单查看答案及解析
-
下列有关物质的性质或应用说法不正确的是
A.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹
B.浓硫酸能干燥氯气、一氧化碳等气体,说明浓硫酸具有吸水性
C.二氧化硫具有漂白性,所以能使溴水和品红溶液褪色
D.福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生
难度: 简单查看答案及解析
-
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A. Fe2+、CO32-、Br- B.Na+、SO32-、I-
C.Fe2+、I-、SO32- D.Na+、Br-、CO32-
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D、E原子序数依次递增,A、B两元素相邻,B、C、E原子最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A. 元素B和E的氧化物对应的水化物均为强酸
B.C的单质能与A的氧化物发生置换反应
C.元素C、D、E的最高价氧化物对应的水化物之间均可相互反应
D.工业上常用电解元素C、D的氯化物来制取它们的单质
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式为
A.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
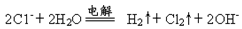
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32- +H2O
C.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:
3AlO2-+ 6H+= 2 Al(OH)3↓+ Al3+
D.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO-+ 2H2O = Fe(OH)2↓ + 2HClO
难度: 简单查看答案及解析
-
利用下列实验装置能完成相应实验的是
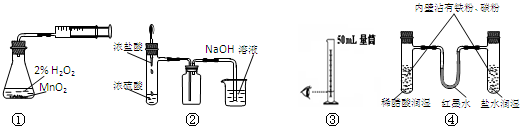
A.装置①测定化学反应速率 B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸 D.装置④模拟铁的腐蚀
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n
B.标准状况下,NO和 O2各11.2 L 混合,所得混合气体的分子总数为 0.75 NA
C. 25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,OH-离子数为10-7 NA
D.两份2.7g铝分别与100mL浓度为2 mol·L―1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA
难度: 简单查看答案及解析
-
以下物质间的每步转化,不能通过一步反应实现的是
A.S→SO2→H2SO4→MgSO4 B. Al→Al2O3→Al(OH)3→NaAlO2
C. Fe→FeCl2→Fe(OH)2→Fe(OH)3 D.N2→NO→NO2→HNO3
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是
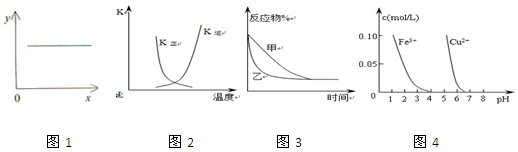
A.图1表示反应2NO(g)+2CO(g)
N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化
B.图2中表示反应2A(g) + B(g)
2C(g) ΔH > 0的平衡常数K随温度的变化
C.图3表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5左右
难度: 简单查看答案及解析
-
CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:
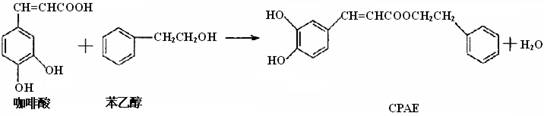
下列说法不正确的是
A.咖啡酸分子中所有原子可能处在同一个平面上
B.可用金属Na检测上述反应是否残留苯乙醇
C.1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2
D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH
难度: 简单查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
难度: 简单查看答案及解析
-
某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈酸性,Na2HXO4溶液呈碱性。50℃时,浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)•c(OH-) > 1×10-14
B. c(Na+)+ c(H+)=c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-)
C.c(H+) + 2c(H3XO4) + c(H2XO4-) = c(XO43-) + c(OH-)
D.c(H+) + c(H3XO4)=c(HXO42-)+ 2c(XO43-)+ c(OH-)
难度: 简单查看答案及解析
-
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法正确的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1
B.NF3是一种无色、无臭的气体,因此NF3泄漏时常常不易被察觉]
C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染
D.若反应中转移的电子数目为6.02×l023,则生成22.4L NO气体
难度: 简单查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g) 、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
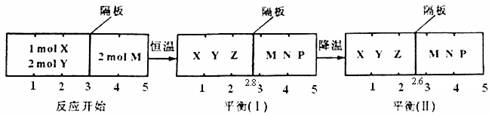
下列判断正确的是
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.在平衡(I)和平衡(II)中M的体积分数相等
D.达平衡(I)时,X的转化率为5/11
难度: 简单查看答案及解析
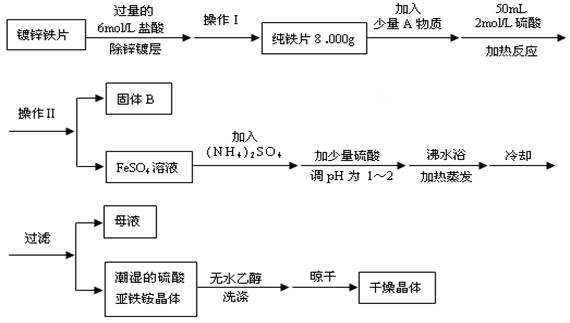
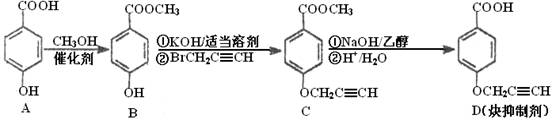 (1)化合物A核磁共振氢谱有________种峰。
(1)化合物A核磁共振氢谱有________种峰。