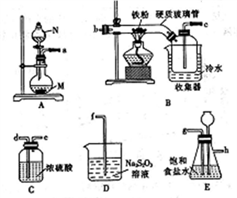
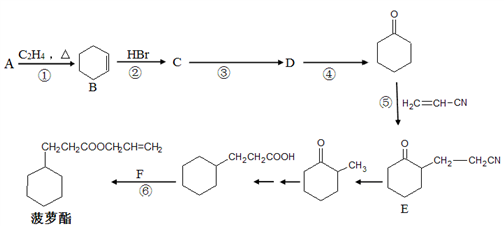
-
化学与生产、生活、环境等息息相关,下列有关说法中正确的是
A. 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同
B. 工业上生产玻璃、水泥均需要用石灰石为原抖
C. 绿色化学的核心是应用化学原理对环境污染进行治理
D. 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程是物理变化
难度: 简单查看答案及解析
-
下列说法正确的是
① 1 mol铁在一定条件下分别与氧气、氯气、硫完全反应转移电子数均为2NA
②质子数为92、中子数为142的铀(U)原子:
U
③向苯酚钠溶液中通入少量的 CO2:CO2 + H2O+ 2C6H5O-
2C6H5OH + CO32-
④在由水电离出的c (OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤冰中既存在范德华力,又存在氢键
⑥1, 3-二甲基丁烷:

A. ②⑤⑥ B. ②④ C. ④⑤ D. ①③⑥
难度: 中等查看答案及解析
-
环扁桃酸酯的结构简式如图所示,下列说法不正确的是

A. 环扁桃酸酯的分子式为C17H24O3
B. 环扁桃酸酯在水中几乎不溶,在乙醇或丙酮中易溶解
C. 环扁桃酸酯可以发生加成、取代、消去等反应
D. 1 mol环扁桃酸酯最多可以与1mol NaOH反应
难度: 中等查看答案及解析
-
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
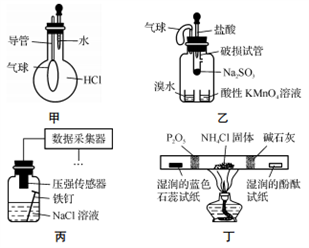
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
难度: 中等查看答案及解析
-
常温下,电解质溶液中的下列关系式不正确的是
A. 已知A-+H2B(过量)==HA+HB-,则结合H+的能力:HB-<A-<B2-
B. 在0.1mol·L-1的氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时, c(NH4+)+c(NH3 •H2O)=0.05 mol·L-1
C. 将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数ka=
D. 将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)> c(K+)> c(Al3+)> c(H+)> c(OH-)
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
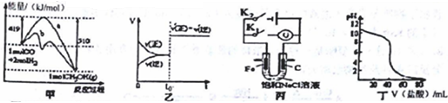
A. 图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g)
CH3OH(g)。该反应的 △H=-91 kJ·mol-1
B. 图乙表示己达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改 变的条件可能处加入催化剂
C. 图丙中若K1闭合,石墨棒周围液pH逐渐升高;若K2闭合,电路中通过0.002NA 个电子时,两极理论上共产生0.002mol气体
D. 图丁表示盐酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲线,该实验的指示剂最好选取酚酞
难度: 中等查看答案及解析


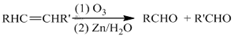 (R,R’代表烃基或氢)
(R,R’代表烃基或氢)