-
下列有关物质的性质与应用不相对应的是
A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水
D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
难度: 中等查看答案及解析
-
下列化学用语的表述不正确的是
A.过氧化氢的结构式:H—O—O—H
B.2,2-二甲基丁烷的实验式:C3H7
C.质子数与中子数相等的氢原子符号:
D.Cl-的结构示意图:
难度: 中等查看答案及解析
-
下列说法正确的是
A.鸡蛋清溶液中加入醋酸铅溶液会变性
B.淀粉和纤维素互为同分异构体,化学式均为(C6H10O5)n
C.油脂在酸性条件下的水解反应叫皂化反应
D.淀粉、纤维素、蛋白质和油脂均属于天然高分子化合物
难度: 中等查看答案及解析
-
下列关于物质的用途或变化,说法正确的是
A.Al2O3熔点很高,可用作耐火材料
B.高纯度的硅单质用于制作光导纤维
C.铝热反应是炼铁最常用的方法
D.N2与O2在放电条件下直接化合生成NO2
难度: 中等查看答案及解析
-
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
A.称取3g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“—OH”
难度: 中等查看答案及解析
-
下列化学反应属于加成反应的是

难度: 中等查看答案及解析
-
如图是元素周期表的一部分,下列关系正确的是
A.还原性:Se2->S2->Cl-
B.热稳定性:HCl>H2Se>HBr
C.原子半径:Se>Cl>S
D.酸性:HBrO4>HClO>H2SO4
难度: 中等查看答案及解析
-
在pH=13的无色溶液中,下列各组离子能大量共存的是
A.K+、Na+、
、
B.Na+、
、
、Cl-
C.K+、Na+、
、Br- D.K+、Cu2+、Cl-、
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=
+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:
+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+
+4H+=Cu2++NO↑+2H2O
难度: 中等查看答案及解析
-
设阿伏加德罗常数为NA,下列说法正确的是
A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA
B.1mol NH3含有的电子数10NA
C.常温常压下,22.4 L的氧气含氧原子数为2NA
D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA
难度: 中等查看答案及解析
-
在相同温度下,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.电离的程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是

难度: 中等查看答案及解析
-
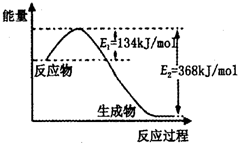
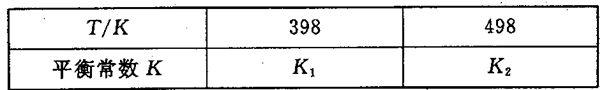
在密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是

A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.反应CO(g)+H2O(g)
CO2(g)+H2(g)△H>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是

难度: 中等查看答案及解析
-
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8 kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g)=2H2O(l) △H=-285.8 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=+571.6 kJ/mol
C.2H2(g)+O2(g)=2H2O(g) △H=-571.6kJ/mol
D.H2(g)+
O2(g)=H2O(l) △H=-285.8 kJ/mol
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是

A.②③ B.①④ C.②④ D.③④
难度: 中等查看答案及解析
-
、
、
、
电子层结构相同。关于A、B、C、D四种元素叙述正确的是
A.气态氢化物的稳定性:D>C B.一定都是短周期元素
C.单质的还原性:B>A D.原子序数:B>A>C>D
难度: 中等查看答案及解析
-
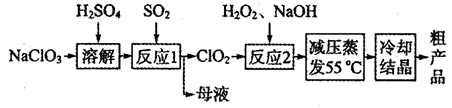
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:

则下列判断正确的是
A.MFe2Ox是还原剂 B.SO2是该反应的催化剂
C.x>y D.SO2发生了置换反应
难度: 中等查看答案及解析
-
下列叙述正确的是
A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等
D.在NaHCO3溶液中:c(OH-)+c(
)=c(H+)+c(H2CO3)
难度: 困难查看答案及解析