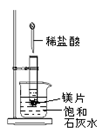
-
下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.它们的原子半径、失电子能力随核电荷数的增加而增大
B.被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的颜色随核电荷数的增加而加深
难度: 中等查看答案及解析
-
放射性同位素U的原子核内的中子数和核外电子数之差是 ( )
A.54 B.92 C.146 D.238
难度: 简单查看答案及解析
-
雷雨天闪电时空气中有臭氧生成,下列说法正确的是( )
A.16O2和18O3互为同位素
B.O2和O3的相互转化是物理变化
C.等物质的量的O2和O3含有相同的质子数
D.等质量的O2和O3含有相同的O原子数
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.氯气与氢气化合比溴与氢气化合容易 B.硒化氢比硫化氢稳定
C.氢氧化锶比氢氧化钙的碱性强 D.铍的原子失电子能力比镁弱
难度: 中等查看答案及解析
-
下列关于铷(Rb)的叙述中正确的是( )
A.它位于周期表的第四周期、第ⅠA族
B.在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小
C.氢氧化铷是弱碱
D.硝酸铷是离子化合物
难度: 中等查看答案及解析
-
下列关于物质性质的比较,不正确的是 ( )
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Al>P>N
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
难度: 中等查看答案及解析
-
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的还原性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
难度: 中等查看答案及解析
-
下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
A.全部可以 B.仅②可以 C.仅②③可以 D.①③④可以
难度: 中等查看答案及解析
-
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
A.原子半径:W>X>Z>Y B.热稳定性:H2Y>HZ
C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
难度: 中等查看答案及解析
-
下列有关氢化物的叙述中正确的( )
A.气态氢化物稳定性:PH3 > CH4
B.HCl的电子式为
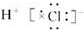
C.D2O分子所有原子均达到最外层8e—稳定结构
D.VIIA族元素中F的最高价氧化物对应水化物酸性最强
难度: 中等查看答案及解析
-
下列物质中,只含有非极性共价键的是( )
A.Na2O2 B.KCl C.H2S D.N2
难度: 中等查看答案及解析
-
下列关于化学键的说法中不正确的是( )
A.化学键可以使离子相结合,也可以使原子相结合
B.非金属元素的原子之间只能形成共价键
C.化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成
D、化学键是一种作用力
难度: 中等查看答案及解析
-
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.物质发生化学反应都伴随着能量变化
B.干冰汽化需吸收大量的热,这个变化是吸热反应
C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量[
D.放热反应的发生无需任何条件
难度: 简单查看答案及解析
-
“生物质”是指由植物或动物生命体衍生得到的物质的总称。 “生物质能”主要指用树木、庄稼、草类等植物直接或间接提供的能量。下面有关“生物质能”的说法,不正确的是 ( )
A.利用生物质能就是间接利用太阳能 B.生物质能源是可再生的能源
C.生物质能源是解决农村能源的主要途径 D.生物质能的缺点是严重污染环境
难度: 中等查看答案及解析
-
下列关于充电电池的叙述,不正确的是 ( )
A.充电电池可以通过放电、充电实现化学能和电能的相互转化
B.放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应
C.现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理
D.充电电池的化学反应原理是氧化还原反应
难度: 中等查看答案及解析
-
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH—4e-=4H2O O2+2H2O+4e-=4OH- 据此作出判断,下列说法中错误的是( )
A.供电时的总反应是:2H2+O2=2H2O
B.产物为无污染的水,属于环境友好电池
C.燃料电池的能量转化率无法达到100%
D.H2在负极发生还原反应
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极得电子反应产物是Mn2O3(s)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是( )
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Y>X>Z
难度: 中等查看答案及解析
-
形成原电池的条件一般有:①电解质溶液;②两个电极;③能自发地发生氧化还原反应;④形成闭合回路,请根据上述条件判断下列装置中属于原电池的是( )

难度: 中等查看答案及解析
-
如下图所示的装置的中,观察到电流计指正偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
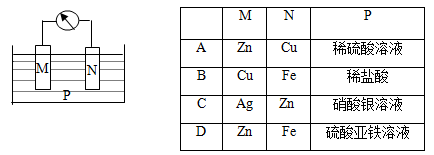
难度: 中等查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化:2SO2+O2
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等
难度: 中等查看答案及解析
-
温度为500℃时,反应4NH3+5O2
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
(x)为 ( )
A.
(O2)=0.01mol/(L•s) B.
(NO)=0.08mol/(L•s)
C.
(H2O)=0.0013mol/(L•s) D.
(NH3)=0.002mol/(L•s)
难度: 中等查看答案及解析
-
对10mL1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.加入一定量的CaCl2 B.加入5mL1.5mol/L的盐酸
C.加入15mL0.5mol/L的盐酸 D.加入5mLH2O
难度: 中等查看答案及解析