-
pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系量是
A.m=n B.m>n C.m<n D.无法判断
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
A.①②③④ B.③⑤⑥⑦ C.④⑤⑥⑦ D.③④⑤⑥⑦
难度: 简单查看答案及解析
-
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
设C(g)+CO2(g)
2CO(g) △H>0 ,反应速率为v 1,N2(g)+3H2(g)
2NH3(g) △H<0反应速率为v 2,对于上述反应,当温度升高时,v 1和v 2的变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
难度: 简单查看答案及解析
-
在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0.8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH3的物质的量
A.等于0.8 mol B.等于1.6 mol
C.大于0.8 mol小于1.6 mol D.大于1.6 mol
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa条件下:
(1)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
(2)4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
下列热化学方程式中△H表示可燃物燃烧热的是
A.C(s) + 1/2 O2(g) = CO(g) △H= -110.5 kJ/mol
B.2H2(g) + O2(g) = 2H2O(l) △H= -571.6kJ/mol
C.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-802.3kJ/mol
D.CO(g) + 1/2 O2(g) = CO2(g) △H= -283.0kJ/mol
难度: 简单查看答案及解析
-
已知450℃时,反应H2(g)+I2(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
难度: 中等查看答案及解析
-
冰融化成水的过程的焓变和熵变正确的是
A.△H>0,△S<0 B.△H<0,△S>0
C.△H>0,△S>0 D.△H<0,△S<0
难度: 简单查看答案及解析
-
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)
CO(g)+H2(g) 乙:CO(g)+H2O(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体的平均摩尔质量不再改变
②恒温时,气体压强不再改变
③断裂氢氧键的速率等于断裂氢氢键速率的2倍
④各气体组分的物质的量浓度相等
⑤混合气体的密度不变
⑥同一段时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量
⑦单位时间内,消耗水蒸气的质量与生成氢气的质量比9︰1
其中能表明甲、乙容器中反应都达到化学平衡状态的是
A.①②⑥ B.③⑥ C.④⑦ D.③④⑦
难度: 中等查看答案及解析
-
下列化学事实,能用勒夏特列原理解释的是
A.对于可逆反应:H2(g)+Br2(g)
达到化学平衡后,增大压强时,混合气体颜色变深。
B.合成氨工业中温度选择为500℃。
C.配制Al2(SO4)3溶液时加入少量稀硫酸。
D.合成氨工业采用循环操作,可提高原料利用率。
难度: 中等查看答案及解析
-
在容积可变的密闭容器中,充入适量X与Y的混合气,一定条件下发生反应:X(气)+3Y(气)
2Z(气)若维持温度与压强不变,达平衡时,容器容积为VL,其中Z占10%,下列推断中,正确的是
A.原X、Y混合气体积为1.2VL
B.原X、Y混合气体积为1.1VL
C.达平衡时,消耗X体积为0.25VL
D.达平衡时,消耗Y体积为0.05VL
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率增大 B.平衡向正反应方向移动
C.C的体积分数变大 D.a < c+d
难度: 中等查看答案及解析
-
关于电解NaCl 水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
难度: 中等查看答案及解析
-
反应2X(g) + Y(g)
2Z(g)(正反应放热),在不同温度(T1. T2)及压强(P1. P2)下,产物的物质的量(n)与时间的关系图如下,则以下判断正确的是
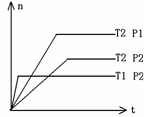
A.T1<T2 P1<P2
B.T1<T2 P1>P2
C.T1>T2 P1>P2
D.T1>T2 P1<P2
难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2 B. Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
难度: 简单查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是
A.27mg B.54mg C.108mg D.216mg
难度: 中等查看答案及解析
