-
2011年的云南曲靖铬污染事故尚未平息,时隔半年,2012年广西柳州的龙江河镉污染事故再一次令人触目惊心,环境保护刻不容缓。关于
说法正确的是:( )
A.
与
是同素异形体关系
B.
含有24个中子
C.
与
互为同位素,物理性质、化学性质均相同
D.
中子数比电子数多4个
难度: 简单查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是:( )
A.CO2的电子式:
B.质量数为37的氯原子:1737Cl
C.NH4Cl的电子式: D.原子核内有10个中子的氧原子:
难度: 简单查看答案及解析
-
下列关于化学键说法正确的是: ( )
A.构成单质分子的微粒中不一定含有化学键
B.只含有共价键的物质一定是共价化合物
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2 中既有共价键又有离子键
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ② 单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤ 混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
难度: 简单查看答案及解析
-
下列说法中正确的是:( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
D.在周期表里,主族元素所在的族序数等于原子核外电子数
难度: 简单查看答案及解析
-
下列实验中,可以加快反应速率的是:( )
A.钠与水反应时,增加水的量
B.锌与稀硫酸反应时,加入少量CuSO4固体
C.用18mol/L的硫酸溶液代替 2mol/L硫酸溶液常温下与铝反应
D.合成氨反应,恒容通入氦气
难度: 简单查看答案及解析
-
下列各组物质的性质比较中,不正确的是:( )
A.金属性强弱:Na >Mg>Al B.氢化物稳定性:HF > H2O >NH3
C.碱性强弱:KOH>NaOH>LiOH D.酸性强弱:HIO4 >HBrO4>HClO4
难度: 简单查看答案及解析
-
关于原电池说法不正确的是:( )
A.右图所示原电池中,Cu为正极
B.右图所示原电池中,开关闭合时,化学能主要转变为电能;断开时,化学能主要转变为热能
C.在原电池中,负极上发生氧化反应,正极上发生还原反应
D.在原电池中,电子从负极经过电解质溶液流向正极
难度: 简单查看答案及解析
-
某元素原子序数为85,下面关于该元素说法不正确的是:( )
A.AgAt 不溶于水
B.HAt很不稳定
C.At的单质是白色固体
D.该元素位于元素周期表第六周期、第十七列
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.需要加热才能发生的反应一定是吸热反应
B.在甲烷燃烧反应中,化学能只转化为热能
C.旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对大小决定了反应是放热还是吸热
D.吸热反应在常温下不能发生
难度: 简单查看答案及解析
-
某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含电子的物质的量是:( )
A.(A-N+m)mol B.(A-N)mol
C. ( A-N)mol D. (A-N+m)mol
难度: 简单查看答案及解析
-
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用右图表示,下列叙述中不正确的是 ( )
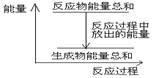
A.1 molZn的能量高于1 molH2的能量
B.反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量
C.如果Zn足量,反应速率会经历由慢到快到慢的过程
D.用锌粉代替锌粒,速率会加快
难度: 简单查看答案及解析
-
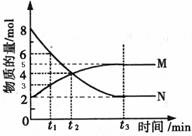
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是:( )
A.V(N2)=0.1mol·L-1·S-1 B.V(H2)=0.1mol·L-1·min-1
C.V(NH3)=0.15mol·L-1·min-1 D.V(H2)=0.3mol·L-1·min-1
难度: 简单查看答案及解析
-
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是:( )
元素
X
Y
Z
W
原子半径(nm)
0.102
0.130
0.073
0.071
最高正价或最低负价
+6
+2
-2
-1,W无正价
A.HW水溶液可以保存在玻璃瓶中 B.X的单质与Z的单质反应生成XZ3
C.Z的最高正价为+6 D.原子序数X>Y>W>Z
难度: 简单查看答案及解析
-
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
难度: 简单查看答案及解析
-
假设某化学反应的反应过程如下图表示:( )
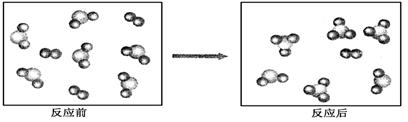
观察分析,符合图中变化的化学反应为
A. A2+3B2
2AB3 B. 2AB2+B2
2AB3
C. 2A2B+5B2 =4AB3 D. 2AB2+B2 = 2AB3
难度: 简单查看答案及解析