-
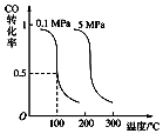
CO和H2在ThNi5作用下可以合成CH4。
已知温度为T时:① CO(g)+H2O(g) === CO2(g)+H2(g) ΔH=-41 kJ·mol-1
② CH4(g)+2H2O(g) === 4H2(g) + CO2(g) ΔH=+165 kJ·mol-1
下列说法不正确的是( )
A.催化剂不能改变该反应的ΔH
B.①中反应物的键能总和小于生成物的键能总和
C.②中反应物的总能量高于生成物的总能量
D.CO(g)与H2(g)合成CH4(g)的反应为放热反应
难度: 中等查看答案及解析
-
有两位同学在条件相同的情况下,测定可逆反应:A2+3B2
2C2的化学反应速率。甲测得:v(A2)=0.5 mol/(L·min),乙测得:v(B2)=1.5 mol/(L·min),则这两位同学的测定结果( )
A.都正确
B.都不正确
C.甲正确,乙不正确
D.都对或都错
难度: 中等查看答案及解析
-
100 mL 6 mol·L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠(固体) B.水 C.碳酸氢钠溶液 D.氨水
难度: 中等查看答案及解析
-
下列叙述中说明某化学平衡一定发生移动的是( )
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.反应产物的总能量大于反应物的总能量时,△H<0
B.已知反应H2 (g)+I2(g)
2HI(g)平衡常数为K,则2H2 (g)+2I2(g)
4HI(g)的平衡常数为2K
C.ΔH<0、ΔS>0的反应在温度低时不能自发进行
D.在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向
难度: 中等查看答案及解析
-
25℃,下列溶液的pH值最小的是( )
A.0.01mol·L-1HCl
B.pH=2的H2SO4溶液
C.c(OH-)=10-13 mol·L-1
D.pH=1溶液加水稀释1倍
难度: 中等查看答案及解析
-
下列对于水的电离平衡叙述不正确的是( )
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中加入金属钠,c(H+)减小
D.向水中通入氯化氢气体,平衡正向移动
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-)
B.0.lmol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L
C.pH=11的NaOH溶液与pH =3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)> c(OH-)= c(H+)
D.浓度均为0.1 mol/L的 ① NH4Cl ②NH4Al(SO4)2 ③ NH4HCO3三种溶液,其中c(NH4+):③>①>②
难度: 困难查看答案及解析
-
下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
A.升高温度,AgCl的溶解度减小
B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数
C.AgCl沉淀生成和溶解不断进行,但速率相等
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变
难度: 中等查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e- = H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-=2H2O(l)
C.CH3OH(g)+H2O(l)-6e- =CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e- =4OH-
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是( )
A.钢铁在弱碱性条件下发生电化学腐蚀的正极电极反应式:O2+2H2O+4e-===4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.牺牲阳极的阴极保护法,实际上“牺牲”的是原电池的负极
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
难度: 中等查看答案及解析
-
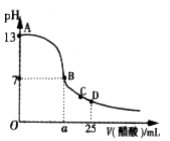
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中所有粒子的浓度都减少
B.溶液中
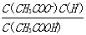 不变
不变C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mL pH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
难度: 困难查看答案及解析
-
电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag,下列说法错误的是( )
A.该电池工作时,电解质中的阴离子向负极移动
B.该电池负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池的正极是Zn,负极是Ag2O
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小65 g
难度: 中等查看答案及解析
-
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )
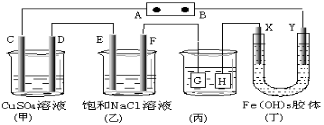
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.C、D、E、F电极均有单质生成,其物质的量比为1∶1∶2∶2
难度: 困难查看答案及解析