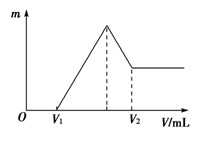
-
下列物质属于电解质的是
A.稀硫酸 B.铜片 C.二氧化碳 D.熔融氯化钾
难度: 简单查看答案及解析
-
化学概念是对化学现象与事实的总结和概括.下列说法中正确的是
A.分散系只包括溶液和胶体
B.丁达尔效应是光线通过胶体时能看到光亮的“通路”的现象
C.单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与l mol物质的质量完全相同
D.物质失电子的反应为还原反应
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol NH4+ 所含质子数为10NA
B.16克氧气和16克臭氧中所含原子数均为NA
C.1mol氯气被氢氧化钠溶液完全吸收,转移的电子数为2NA
D.标准状况下,44.8L水中所含的分子数为2NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.金属铝投入到氢氧化钠溶液中:2Al+2OH=2 AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉 Fe3++Fe = 2Fe2+
D.二氧化碳通入碳酸钠溶液中:
难度: 中等查看答案及解析
-
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②ClO- ③Cl- ④HClO ⑤ H+ 减少的是
A.①②④ B.①②③ C.①④ D.②④
难度: 中等查看答案及解析
-
下列叙述中正确是
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗的主要原因是:2Na+O2 = Na2O2
B.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物的主要原因是:2Na2O2+2CO2 = 2Na2CO3+O2
C.小苏打的主要成分是碳酸钠,NaHCO3的热稳定性大于Na2CO3
D.金属钠着火时,用干燥的细沙土覆盖灭火
难度: 中等查看答案及解析
-
将过量的CO2分别通入下列溶液中,最终有沉淀析出的溶液是
①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液
A.①②③④ B.只有②④ C.只有①②③ D.只有②③
难度: 中等查看答案及解析
-
下列叙述中不正确的是
A.Fe在少量Cl2中燃烧生成FeCl2,在足量Cl2中燃烧生成FeCl3
B.在空气中用小火慢慢加热蒸干硫酸亚铁溶液,不会得到纯净的硫酸亚铁固体,
C.鉴别Fe2+和Fe3+,可以使用酸性KMnO4溶液 ,也可使用KI淀粉溶液
D.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
难度: 中等查看答案及解析
-
用98%的浓硫酸(密度1.84g · mL-1)配制100mL 1mol·L-1的稀硫酸。现给出下列配制中可能用到的仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按使用仪器的先后顺序作出的下列排列中正确的是
A.④③⑥⑦⑤⑥ B.②⑥③⑦⑤⑥ C.①③⑤⑦⑤⑥ D.②③⑥⑦⑤⑥
难度: 中等查看答案及解析
-
下列物质的用途错误的是
A.硅是制造太阳能电池的常用材料 B.二氧化硅是制造光导纤维的材料
C.石英是制取水泥的原料 D.水玻璃可用作木材防火剂
难度: 中等查看答案及解析
-
下列除杂质的操作中不正确的是
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目几乎没有变化的是
A.Fe3+ B.Al3+ C.NH4+ D.Fe2+
难度: 中等查看答案及解析
-
某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、Cl-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、SO42- D.K+、Ca2+、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液
A.①④ B.②③④ C.②③ D.①③④
难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一难溶物质,用CuSO4溶 液和另一种“反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。 下列有关推断中错误的是
A.这里的“另一种反应物”具有还原性 B.CuH可作氧化剂、还原剂
C.CuH+ Cl2==CuCl+ HCl(点燃) D.CuH+ HCl==CuCl+H2↑
难度: 中等查看答案及解析
-
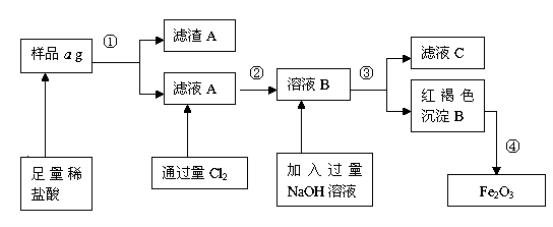
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
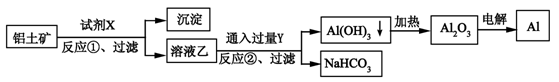
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
难度: 中等查看答案及解析
-
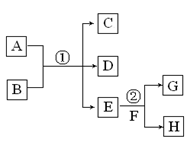
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C、CO ②AlCl3、Al(OH)3 ③Fe、FeCl3 ④Na2CO3、NaHCO3
A.只有①② B.只有③④ C.只有①②④ D.①②③④
难度: 中等查看答案及解析
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42- 的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
难度: 中等查看答案及解析