-
19世纪门捷列夫的突出贡献是 ( )
A. 制出了第一张元素周期表 B.提出了分子学说
C.发现了稀有气体 D.提出了原子学说
难度: 简单查看答案及解析
-
以下说法不正确的是( )
A.利用太阳能将水转化为氢能的设想理论上是可行的
B.寻找高效催化剂,使水分解产生氢气,同时释放能量
C.燃烧反应、中和反应都是放热反应
D.原电池中电子流出的极为负极,发生氧化反应
难度: 简单查看答案及解析
-
在元素周期表的金属与非金属的分界线附近可以寻找( )
A.稀有金属材料 B. 耐高温耐腐蚀的合金材料
C.催化剂材料 D. 半导体材料
难度: 简单查看答案及解析
-
是重要的核工业原料,在自然界的丰度很低。
的浓缩一直为国际社会关注。下列有关
说法正确的是( )
A.
原子核中含有92个中子 B.
原子核外有143个电子
C.
与
互为同位素 D.
与
互为同素异形体
难度: 简单查看答案及解析
-
下列关于物质性质变化的比较中,不正确的是( )
A.离子还原性强弱:F->Cl->Br->I- B. 原子半径:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3
难度: 简单查看答案及解析
-
下列化合物中阳离子与阴离子的半径比最小的是( )
A.LiF B.KF C.LiI D.KI
难度: 简单查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A. O、P、Cl B. B、Mg、Si C. Be、Na、Al D. C、Al、P
难度: 简单查看答案及解析
-
下列电子式书写正确的是( )
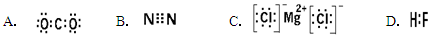
难度: 简单查看答案及解析
-
下列物质中,含有非极性共价键的离子化合物是:( )
A.H2O2 B. Na2O2 C. NaOH D.NH3
难度: 简单查看答案及解析
-
已知 X+、 Y2+、 Z-、 W2-四种离子均具有相同的电子层结构。下列关于 X、Y、Z、W 四种元素的描述,正确的是 ( )
A.原子半径: X>Y>Z>W B.原子序数: Y>X>Z>W
C.原子最外层电子数: Y>X>Z>W D.金属性: X>Y ,还原性:W2- <Z-
难度: 简单查看答案及解析
-
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.该化学反应进行时,只有能量被吸收,故为吸热反应
D.X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
下图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是( )
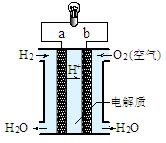
A. 电子由b通过灯泡流向a
B. a极是负极
C.正极的电极反应是:O2+4H++4e-=2H2O
D.氢氧燃料电池是环保电池
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.废旧电池应集中回收,并填埋处理
B.锌锰干电池工作一段时间后碳棒变细
C.太阳能电池的主要材料是高纯度的二氧化硅
D.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
难度: 简单查看答案及解析
-
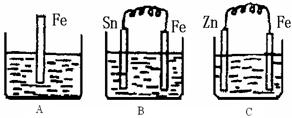
用铁片与稀硫酸反应制取氢气时,下列措施不能使产生氢气的速率加快的是( )
A. 加热 B.不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
难度: 简单查看答案及解析
-
一定温度下,反应A2(g)+B2(g)
2AB(g)达到化学平衡状态的标志是( )
A.A2、B2和AB的浓度不再改变 B.A2、B2和AB在密闭容器中共存
C.容器内的压强不随时间而改变 D.单位时间里每生成1molA2,同时生成1molB2
难度: 简单查看答案及解析
-
对于A2 + 3B2
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol/(L•s); B. v(A2) =0.4mol/(L•s);
C.v(C) =0.6mol/(L•s); D.v(B2) =4.2mol/(L•min)。
难度: 简单查看答案及解析
-
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子的物质的量为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
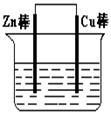
如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,两圈恰好平衡。小心地从烧杯中央滴入硫酸铜溶液。片刻后可观察到悬吊的金属圈( )
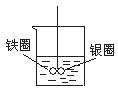
A.保持平衡状态不变 B.铁圈和银圈左右摇摆不定
C.铁圈向下倾斜 D.银圈向下倾斜
难度: 简单查看答案及解析