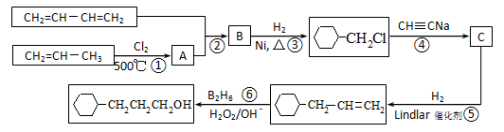
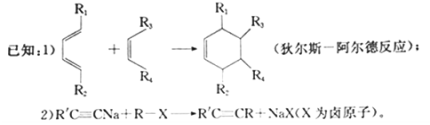
-
下列说法错误的是
A. 氧化钙用作儿童食品的干燥剂存在安全隐患
B. “地沟油”经过加工处理后,可以用来制肥皂和生物柴油
C. 雾霾天气对人体健康造成危害,“雾”和“霾”的分散质微粒不相同
D. 绿色化学的核心是利用化学原理对环境污染进行治理
难度: 简单查看答案及解析
-
若NA表示阿伏伽德罗常数的值,下列说法正确的是
A. 1L 1mol·L-1的NaClO溶液中含有ClO-的数目为NA
B. 78g苯中含有C=C键的数目为3NA
C. 7.8gNa2O2固体中含有的离子总数为0.3NA
D. 标准状况下,将分子总数为NA的NO和O2充分混合后,所得混合气体的体积约为22.4L
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,可能大量共存的是
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下,
=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
难度: 困难查看答案及解析
-
瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是
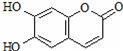
A. 与稀H2SO4混合加热不反应
B. 不能使酸性高锰酸钾溶液褪色
C. 1mol 瑞香素最多能与3mol Br2发生反应
D. 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol
难度: 中等查看答案及解析
-
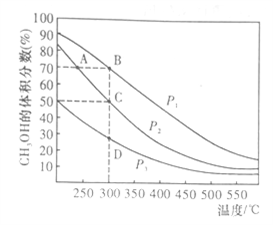
常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是

A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
难度: 困难查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A. A、D两种元素形成的化合物中只含有极性键
B. A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性
C. 原子半径由大到小的顺序是F>E>C>D
D. 最高价氧化物对应水化物酸性最强的元素是C
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是
实验操作
实验目的
A
将SO2通入紫色石蕊溶液中
证明SO2具有漂白性
B
取两支试管,分别加入4mL0.01mol·L-1KMnO4溶液,然后向另一支试管中加入0.1mol·L-1H2C2O4溶液2ml,向另一支试管中加入0.1mol·L-1H2C2O4溶液4mL,记录褪色时间
证明草酸浓度越大,反应速率越快
C
向10ml0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀
证明在相同温度下的溶度积:
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
D
向含酚酞的Na2SO3溶液中加入BaCl2溶液
证明Na2SO3溶液中存在水解平衡
A. A B. B C. C D. D
难度: 中等查看答案及解析