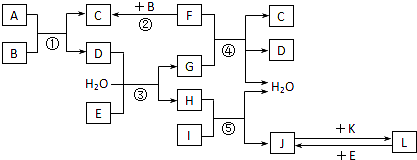
-
有M和R两种短周期主族元素,已知M+与R2-核外电子数之和为20,则下列说法中正确的是( )
A.R一定是第二周期元素
B.M一定是第三周期元素
C.M与R是同一周期元素
D.R与M元素组成的化合物中可能存在非极性键难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.汽油、柴油和植物油都是碳氢化合物
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.乙醇可以被氧化为乙酸,二者都能发生酯化反应
D.主链含5个碳原子的辛烷,其同分异构体最多只有5种难度: 中等查看答案及解析
-
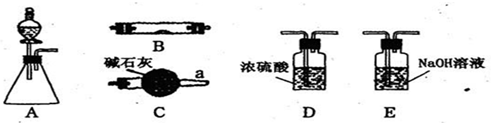
下列实验装置的设计、试剂选用或操作正确的是( )
A.
除去NO中混有的NO2
B.
铁制品表面镀锌
C.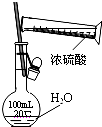
稀释浓硫酸
D.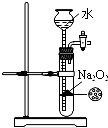
制备少量O2难度: 中等查看答案及解析
-
下列溶液中有关粒子的物质的量浓度关系正确的是( )
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水:c(Na+)=c(NH4+)
C.pH=4的0.1mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.在K2CO3溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)难度: 中等查看答案及解析
-
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)
2HBr(g);△H<0.当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
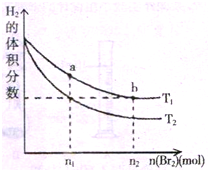
A.由图可知:T2>T1
B.两点的反应速率:a>b
C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
D.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法难度: 中等查看答案及解析
-
用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )
A B C D 甲 KOH H2SO4 Na2SO4 CuSO4 乙 CuSO4 AgNO3 HCl HNO3 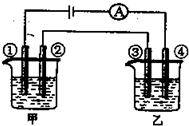
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
现有Na2CO3、Ba( OH)2、H2SO4三种体积和物质的量浓度都相同的溶液,以不同的顺序将它们混合,如生成沉淀,立即过滤掉,对于所得溶液的酸碱性,如下结论不正确的是( )
A.一定显碱性
B.可能显中性
C.不可能显酸性
D.可能显碱性难度: 中等查看答案及解析
-
C和CuO在高温下反应可能生成Cu、Cu20、C02、CO.现将1g碳粉跟8gCuO混合,在硬质试管中隔绝空气高温加热,生成的气体全部通过足量NaOH溶液,收集残余气体.测得溶液增重1.1g,残余气体在标准状况下的体积为560mL.下列说法错误的( )
A.固体混合物高温加热时,有0.6g碳参加了反应
B.试管中的所有氧化还原反应共转移电子0.15mol
C.反应后的试管中固体混合物总质量为7.2g
D.反应生成铜和氧化亚铜的总物质的量为0.1mol难度: 中等查看答案及解析