-
下列关于焓变ΔH的说法正确的是( )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.在一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热ΔH为“-”
难度: 中等查看答案及解析
-
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反
应仍可持续进行,直至反应完全生成新物质硫化亚
铁。这现象说明了( )
A.该反应是吸热反应 B.铁粉和硫粉在常温下可以发生反应
C.该反应是放热反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量
难度: 中等查看答案及解析
-
热化学方程式C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.3 kJ/mol表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水
反应生成一氧化碳和氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);ΔH=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g);ΔH=-269.8kJ/mol(反应热)
D.2NO2=O2+2NO;ΔH=+116.2kJ/mol(反应热)
难度: 中等查看答案及解析
-
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-2153.4kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
难度: 中等查看答案及解析
-
下列变化为放热的化学反应的是( )
A.H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
B.2HI(g)=H2(g)+I2(g) ΔH=+14.9 kJ·mol-1
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
难度: 中等查看答案及解析
-
下列关于电化学的实验事实正确的是( )
出现环境
实验事实
A
以稀H2SO4为电解质的Cu-Zn原电池
Cu为正极,正极上发生还原反应
B
电解CuCl2溶液
电子
经过负极→阴极
阳极→正极
C
弱酸性环境下钢铁腐蚀
负极处产生H2,正极处吸收O2
D
将钢闸门与外加电源负极相连
牺牲阳极阴极保护法,可防止钢闸门腐蚀
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4
KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
难度: 困难查看答案及解析
-
关于下列各装置图的叙述中,不正确的是( )

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
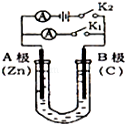
某同学按图所示的装置实验,并把实验情况记录于下,其中叙述合理的是( )
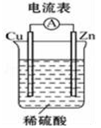
①锌为正极,铜为负极 ②电解质溶液的pH不变
③电流表的指针发生偏转 ④铜极上有气泡产生
⑤电子流动方向为Zn→Cu ⑥溶液中的阳离子向负极移动.
A.①②③ B.③④⑥ C.③④⑤ D.②③④
难度: 中等查看答案及解析
-
暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当( )

A.负极
B.正极 C.阴极 D.阳极
难度: 简单查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面会出现气泡
B.用银片做阳极,铁片
做阴极,电解硝酸银溶液,铁片表面会镀上一层银
C.把锌粒放入盛有稀硫酸的试管中,同时加入几滴硫酸铜溶液,气泡放出速率会加快
D.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
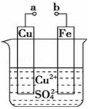
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣═Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
难度: 中等查看答案及解析
-
一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn﹣4e﹣+4OH﹣═2ZnO+2H2O 石墨:2H2O+O2+4e﹣═4OH﹣
下列说法中不正确的是( )
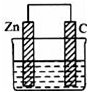
A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池总反应为2Zn+O2═2ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH﹣)增大
难度: 困难查看答案及解析
-
用石墨作电极电解1mol•L﹣1下列物质的溶液,一段时间后溶液的pH增大的是( )
①H2SO4 ②NaOH ③Na2SO4 ④NaCl.
A.只有① B.②④ C.①②④ D.①②③④
难度: 中等查看答案及解析
-
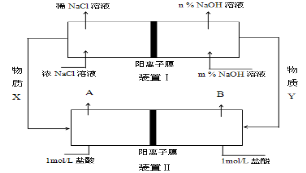
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )
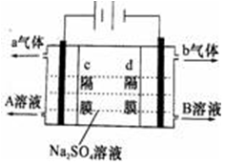
A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O
2H2SO4+4NaOH+O2↑+2H2↑
难度: 困难查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2Mn
O2(s)+H2O(l)
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 困难查看答案及解析
-
可用于电动汽车的铝﹣空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e﹣=4OH﹣
B.以NaOH溶液为电解液时,负极反应为:Al+3OH﹣﹣3e﹣=Al(OH)3↓
C
.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 中等查看答案及解析
-
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
难度: 困难查看答案及解析
-
某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质为FeCl3溶液
B.负极为Fe,正极为C,电解质为Fe(NO3)2溶液
C.正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液
D.负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入
空气,另一极通入丁
烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2﹣.下列对该燃料电池说法不正确的是( )
A.在熔融电解质中,O2﹣移向负极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e﹣=2O2﹣
D.通入丁烷的一极是正极,电极反应为:C4H10+26e﹣+13O2﹣=4CO2↑+5H2O
难度: 中等查看答案及解析
-
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH﹣﹣2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH﹣,根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
难度: 中等查看答案及解析