-
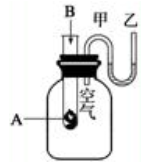
氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏1mol H2中的化学键消耗的能量为Q1 kJ,破坏1mol Cl2中的化学键消耗的能量为Q2 kJ,形成1mol HCl中的化学键释放的能量为Q3 kJ.下列关系式中,正确的是
A.Q1+Q2>Q3
B.Q1+Q2>2Q3
C.Q1+Q2<Q3
D.Q1+Q2<2Q3
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A. 医用“钡餐”的化学式:BaCO3
B. C1-的结构示意图:
C. NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D. N2的电子式:
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C.
得电子能力相同
D. F-、O2-、Mg2+、Na+半径逐渐减小
难度: 中等查看答案及解析
-
2013年12月15日,嫦娥三号着陆器与巡视器分离,“玉兔号”巡视器顺利驶抵月球表面。“玉兔”号是中国首辆月球车,成功实现对月面的科学探测。“玉兔”号用
Pu作为热源材料。下列关于
Pu的说法正确的是
A.
Pu与
Pu具有相同的最外层电子数
B.
Pu与
Pu互为同素异形体
C.
Pu与
U具有完全相同的化学性质
D.
Pu与
U互为同位素
难度: 中等查看答案及解析
-
下列有关叙述:①非金属单质M能从N的化合物中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性HmM<HnN;⑤氧化物水化物的酸性HmMOx>HnNOy;⑥熔点M<N。能说明非金属元素M比N的非金属性强的是
A. ①②④⑤ B. ①②③ C. ①②③⑤ D. 全部
难度: 中等查看答案及解析
-
2005年1月美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构﹣Al13和Al14.已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
A. Al13、Al14互为同位素
B. Al13超原子中Al原子间通过离子键结合
C. Al14最外层电子数之和为42,与第ⅡA族元素的性质相似
D. Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是( )
A. 原子半径C>D>E ,三者形成的简单离子中D离子的半径最小
B. 元素A所形成的氢化物常温下一定为气态
C. 元素C、D、E在自然界中均不能以游离态存在
D. 元素B的氧化物对应的水化物一定为强酸
难度: 中等查看答案及解析
-
化学反应常常伴随能量的变化,以下是H2与Cl2反应的能量变化示意图H2 (g) +Cl2 (g)=2HCl(g)反应的能量变化示意图,下列说法正确的是( )

A. 氯化氢分子的电子式:
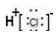 B. 该反应是工业制取盐酸的化学反应原理
B. 该反应是工业制取盐酸的化学反应原理C. 形成1molH—Cl键要吸收431kJ的能量 D. 该反应中反应物总能量小于生成物总能量
难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P—P:198 P—O:360 O=O:498;则反应P4(白磷)+3O2===P4O6的能量变化为( )
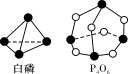
A.释放1638 kJ的能量
B.吸收1638 kJ的能量
C.释放126 kJ的能量
D.吸收126 kJ的能量
难度: 简单查看答案及解析
-
有a、b、c、d四种金属.将a与b用导线接起来,浸入电解质溶液中,a不易腐蚀.将b、d分别投入等浓度的盐酸中,d比b反应强烈.将铜浸入a的盐溶液里,无明显变化.如果把铜浸入c的盐溶液里,有金属c析出.据此判断它们的活动性顺序由强到弱的为
A.a>c>d>b B.d>a>b>c C.d>b>a>c D.b>a>d>c
难度: 中等查看答案及解析
-
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
A. ①⑤ B. ①③④ C. ②④⑥ D. ⑥
难度: 中等查看答案及解析
-
根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2↓+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B﹣2e-=B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是
A.D2+>A2+>B2+>E2+ B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+ D.E2+>B2+>A2+>D2+
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 简单查看答案及解析
-
W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,其L层上电子数是M层上电子数的2倍;在常温常压下,W和R形成的两种物质可相互转化,但元素化合价没有变化;这4种元素的原子最外层电子数之和等于R原子的核电荷数的2倍。下列说法正确的是
A. 元素的非金属性强弱顺序为R>Y>W
B. R与其他三种元素均能形成共价化合物
C. 简单氢化物的热稳定性强弱顺序为R>W>Y
D. 原子半径大小顺序为r(W)>r(R)>r(X)>r(Y)
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)下列说法正确的是( )
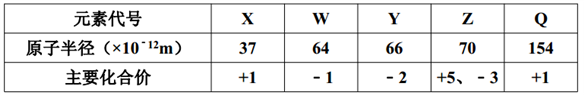
A. 由Q与Y形成的化合物中只存在离子键 B. Z与X之间形成的化合物具有还原性
C. 由X、Y、Z三种元素形成的化合物,一定是共价化合物 D. Y与W形成的化合物中,Y显负价
难度: 困难查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
难度: 困难查看答案及解析
-
X、Y、Z、W均为短周期主族元素,X与W、Y与Z分别位干同一周期,X、Y、Z的最外层电子数依次增大,W的最外层电子数是X与Y的最外层电子数之和,Z的最简单氢化物为甲,W的最简单氢化物为乙,乙是双原子分子且甲、乙混合时有白烟生成,下列说法正确的是( )
A. 原子半径:X>W>Z>Y
B. 化合物ZW3溶于水时水解生成一种弱碱和一种强酸
C. X的最高价氧化物能与Z的最高价氧化物对应的水化物反应
D. 甲、乙混合时生成的白烟为离子化合物,且该化合物只含有离子键
难度: 中等查看答案及解析
-
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
A. XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B. XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C. XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D. XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
难度: 困难查看答案及解析
-
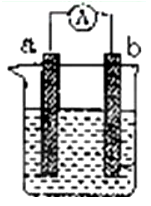
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
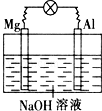
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
难度: 简单查看答案及解析
-
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素有关性质);

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1) IIA族元素的价电子数(______) (2)ⅦA族元素氢化物的沸点(______)
(3)第三周期元素单质的熔点(______) (4)第三周期元素的最高正化合价(______)
(5) lA族元素单质熔点(______) (6) F-、Na+、Mg2+、Al3+四种离子的离子半径(______)
(7)短周期元素的原子半径(______)
难度: 中等查看答案及解析