-
下列说法正确的是
A、凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
B、两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
C、相对分子质量相同的几种化合物,互称为同分异构体
D、组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
难度: 中等查看答案及解析
-
下列有机化合物的分类不正确的是

难度: 简单查看答案及解析
-
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列物质中与该产品互为同分异构体的是

A.CH2===C(CH3)COOH
B.CH2===CHCOOCH3
C.CH3CH2CH===CHCOOH
D.CH3CH(CH3)COOH
难度: 中等查看答案及解析
-
有关
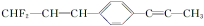 分子结构的下列叙述中,正确的是
分子结构的下列叙述中,正确的是A.除苯环外的其余碳原子有可能都在一条直线上
B.所有的原子都在同一平面上
C.12个碳原子不可能都在同一平面上
D.12个碳原子有可能都在同一平面上
难度: 中等查看答案及解析
-
苯环上有两个取代基的C9H12,其苯环上的一氯代物的同分异构体共有(不考虑立体异构)
A. 6种 B.7种 C.10种 D.12种
难度: 困难查看答案及解析
-
充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等。则X的分子式为
A.C10H16 B.C11H14 C.C12H18 D.C13H20
难度: 中等查看答案及解析
-
如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的

A.CH3CH2CH2CH3 B.(CH3)2CHCH3
C.CH3CH2CH2OH D.CH3CH2COOH
难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列有关σ键的说法错误的是
A.如果电子云图象是由两个s电子重叠形成的,即形成s-s σ键
B.s电子与p电子形成s-p σ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个s-p σ键
难度: 中等查看答案及解析
-
下列分子中,各原子均处于同一平面上的是
A.NH3 B.CCl4 C.H2O2 D.CH2O
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是
A.SO3与SO2 B.BF3与NH3 C.BeCl2与SCl2 D.H2O与SO2
难度: 中等查看答案及解析
-
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是
A.NCl3分子中N—Cl键的键长比CCl4分子中C—Cl键的键长长
B.NCl3分子是非极性分子
C.分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
下列物质中存在配位键的是
①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4
A.①② B.①③ C.④⑤ D.②④
难度: 中等查看答案及解析
-
下表所列物质晶体的类型全部正确的一组是
原子晶体
离子晶体
分子晶体
A
氮化硅
磷酸
单质硫
B
单晶硅
氯化铝
白磷
C
金刚石
烧碱
冰
D
铁
尿素
冰醋酸
难度: 中等查看答案及解析
-
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是
A.X的单质固态时为分子晶体
B.Y的单质为原子晶体
C.X与Y形成的化合物固态时为分子晶体
D.X与碳形成的化合物为分子晶体
难度: 简单查看答案及解析
-
下列各组物质中,按熔点由低到高的顺序排列正确的是
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al
A.①③ B.①④ C.②③ D.②④
难度: 简单查看答案及解析
-
离子晶体稳定性取决于晶体中晶格能的大小。判断KCl、NaCl、CaO、BaO四种晶体稳定性由高到低的顺序是
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl D.CaO>BaO>KCl>NaCl
难度: 中等查看答案及解析
-
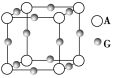
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是
A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4
难度: 简单查看答案及解析
-
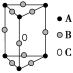
下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为

A.-3 B.-2 C.+3 D.+2
难度: 中等查看答案及解析
-
下面有关晶体的叙述中,不正确的是
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 困难查看答案及解析
-
在40 GPa高压下用激光器加热到1 800 K时成功地制得了原子晶体CO2,下列有关推断正确的是
A.原子晶体CO2易汽化,可用作制冷剂
B.构成原子晶体CO2中的微粒是CO2分子
C.原子晶体CO2有很高的熔沸点,有很大的硬度
D.每摩尔原子晶体CO2中含碳氧键的数目为2NA
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4中含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60 g SiO2中含有Si—O键的个数为2NA
难度: 中等查看答案及解析
-
磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。右图是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为
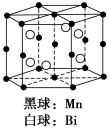
A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3
难度: 困难查看答案及解析
-
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是

A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
难度: 中等查看答案及解析
-
测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为
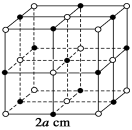
难度: 困难查看答案及解析