-
能用来鉴别四氯化碳、乙醇、己烷、己烯四种无色溶液的一种试剂是
A.金属钠 B.溴水 C.氢溴酸 D.氢氧化钠溶液
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
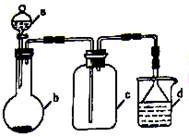
选项 a中的物质 b中的物质 C中收集的气体 d中的物质
A 浓氨水 CaO NH3 H2O
B 浓硫酸 Na2SO3 SO2 NaOH溶液
C 稀硝酸 Cu NO2 H2O
D 浓盐酸 MnO2 Cl2 NaOH溶液
难度: 中等查看答案及解析
-
已知原子序数,可能推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图
⑦元素在周期表中的位置
A.①②③④⑥ B.①④⑤⑥⑦ C.②③④⑤⑦ D.③④⑤⑥⑦
难度: 简单查看答案及解析
-
下列化学变化中,反应物的总能量低于生成物的总能量的是( )
A.2H2 +O2
2H2O
B.CaO + H2O = Ca(OH)2
C.CaCO3
CaO + CO2↑
D.CH3CH2OH(酒精)+ 3O2
2CO2 + 3 H2O
难度: 简单查看答案及解析
-
化学键使得一百多种元素构成了世界的万事万物,关于化学键的下列叙述中,正确的是( )
A.离子化合物一定含有共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.左、下方区域的金属元素 B.金属元素和非金属分界线附近的元素
C.右、上方区域的非金属元素 D.稀有气体元素
难度: 简单查看答案及解析
-
下列关于甲烷与氯气发生取代反应所得生成物的说法正确的是 ( )
A.都是有机物 B.都不溶于水
C.有一种气态物质,其余都是液体 D.有一种是无机物其余都是有机物
难度: 简单查看答案及解析
-
下列各组物质中,都是共价化合物的是( )
A.H2S和Na2O2 B.H2O2和CaF2 C.NH3和N2 D.HNO3和HClO3
难度: 中等查看答案及解析
-
某有机物含有C、H、O三种元素,其中氧的质量分数25%,相对分子质量小于150,一个分子中最多含C原子个数( )
A、10 B、9 C、8 D、7
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述,正确的是:( )
A.ⅡA族中无非金属元素 B.Ⅷ族中所含元素种类最多
C.元素周期表中18个纵行对应18个族 D.零族的所有元素均满足最外层电子数为8
难度: 中等查看答案及解析
-
下列叙述中,甲金属一定比乙金属活泼性强的是:( )
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
难度: 中等查看答案及解析
-
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。下列对于反应
2SO2+O2
2SO3的说法中正确的是:( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
D.在达到平衡的体系中,充入由18O原子组成的O2后, 18O仅存在于SO2和SO3中
难度: 中等查看答案及解析
-
将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生反应:2A(g)+B(g)==2C(g).若经2s后测得C的浓度为0.6mol·L-1,下列几种说法,不正确的是( )
①用物质A表示的平均反应速率为0.3mol·L-1·s-1②用物质B表示的平均反应速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol·L-1
A.①③ B.①④ C.②③ D.③④
难度: 困难查看答案及解析
-
如图所示装置中,M棒变细,N棒变粗。由此判断下表中所列M、N、R物质,其中合理的是
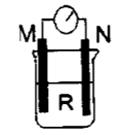
M N R
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银
D 锌 铜 硫酸铜
难度: 中等查看答案及解析
-
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
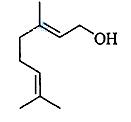
下列有关香叶醇的叙述正确的是 ( )
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪 D.能发生加成反应不能发生取代反应
难度: 中等查看答案及解析
-
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:

下列叙述错误的是.
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.“地沟油”可用于制备生物柴油 D.动植物油脂是高分子化合物
难度: 中等查看答案及解析