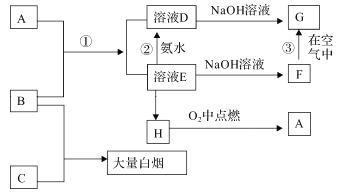
-
下列叙述错误的是( )
A. 丁达尔效应可以用来鉴别胶体和溶液
B. 在水溶液中 NaHSO4 的电离:NaHSO4=Na++ HSO4-
C. 配置 FeSO4溶液时,需加入少量铁粉防止 Fe2+被氧化
D. 碳酸氢钠在医疗上可用于治疗胃酸过多
-
下列叙述正确的是( )
A. 金刚石和石墨是同种物质
B. C60和 CO2均是碳元素的化合物
C. 氧气和臭氧是氧元素的同素异形体
D. 农村常用草木灰和碳酸氢铵一起施用来增加肥效
-
设 NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,11.2 L水所含的分子数为 0.5NA
B. 1.8 g 的 NH4+中含有的电子数为 1.1NA
C. 23g 二氧化氮与标准状况下 11.2LH2含有相同的原子数
D. 2.3 g 金属钠与O2完全反应,转移电子的物质的量为 0.1mol
-
用硫酸铜晶体配制 480mL 浓度为 0.5mol/L的溶液,下列说法正确的是( )
A. 用托盘天平称量60.0g硫酸铜晶体
B. 如果称量时药品和砝码放反了,对配制结果没有影响,因为没有使用游码
C. 如果定容时俯视所配溶液浓度会偏高
D. 在转移溶液后,可以不用洗涤玻璃棒
-
在强酸性溶液中能大量共存的无色透明离子组是( )
A. K+、Na+、CO32-、Cl- B. NH4+、Na 十、Br-、Cu2+
C. Mg2+、Na+、NO3-、SO42- D. Na十、Ba2+、OH-、SO42-
-
下列选项中,实验操作、实验现象以及解释或结论均一致的是( )
| 实验操作 | 实验现象 | 解释或结论 |
| A | 氯气通入盛放湿润红布的集气瓶中 | 红布条褪色 | 说明 Cl2具有漂白性 |
| B | 在 Fe(OH)3胶体中加入稀H2SO4溶液 | 直接变成黄色溶液 | 因为Fe(OH)3与H2SO4 发生了反应生成了黄色的 Fe2(SO4)3 |
| C | 向稀FeCl2溶液中滴加新制氯水,再滴加 KMnO4溶液 | 滴加KMnO4溶液,KMnO4后褪色 | 说明滴加氯水后,Fe2+没有全部被氧化 |
| D | 某无色溶液,加入足量的稀 HCl | 生成无色无味的能使澄清石灰变混浊的气体 | 说明原溶液中含有 CO32- |
A. A B. B C. C D. D
-
下列化学反应的离子方程式,书写不正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B. 向 Ca(OH)2溶液中加少量 NaHCO3溶液:Ca2++ OH- + HCO3-=CaCO3↓ + H2O
C. 氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl-
D. 往 NaHSO4溶液中滴加 Ba(OH)2溶液至SO42-恰好沉淀完全:Ba2++SO42-+2H++2OH-==BaSO4↓+ 2H2O
-
关于离子的检验下列说法正确的是( )
A. 取少许试液于试管中,滴加少量氯水,再滴加 KSCN溶液,溶液变红说明原溶液中含有Fe2+
B. 取少许试液于试管中,加入BaCl2溶液,有白色沉淀生成,说明原溶液中一定有 SO42-
C. 取少许试液于试管中,加入NaOH,产生能使红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
D. 取少许试液于试管中,加入 KSCN 显红色,说明原溶液中一定不含 Fe2+
-
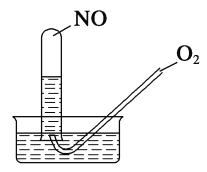
某无色气体,可能由 CO2、HCl、NH3、NO2、NO的几种组成,先通入浓硫酸后,气体减少一部分,再通入足量 Na2O2后,出来的气体为红棕色,将装满红棕色气体的试管倒扣水中,试管中水位上升最后试管中充满水,由此可确定( )
A. 原气体一定含有 NH3、NO2
B. 原气体一定不含有 CO2、NO2、HCl
C. 原气体一定含有 NO、NH3、CO2
D. 原气体中一定含 CO2、NO,且体积比为 V(NO):V(CO2)=4:3
-
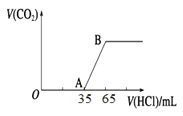
①将 0.1 L 1 mol·L-1的纯碱溶液逐滴滴入 0.1 L 1.25 mol·L-1的盐酸中;②将0.1 L 1.25mol·L-1的盐酸逐滴滴入到 0.1 L 1 mol·L-1的纯碱溶液中。这两种操作产生 CO2 的体积比为( )
A. 2∶1 B. 1∶1 C. 5∶2 D. 2∶5
-
标准状况下将 6.72 L CO2通入1 L 0.5 mol·L-1NaOH 溶液中,当 CO2与NaOH 完全反应时,下列说法正确的是( )
A. 反应后的溶液还可以吸收部分 CO2 B. 溶液中溶质的物质的量之比为 1∶2
C. 反应后有 CO2 逸出 D. 溶液中只有一种阴离子(OH-除外)
-
关于铜与稀硝酸的反应,下列说法不正确的是( )
A. Cu 做还原剂,HNO3做氧化剂
B. 如果 8mol HNO3参与反应,则只能氧化得到2mol NO
C. 每生成 22.4 L(标准状况)NO 有3 mol的电子转移
D. 如果有 2 mol HNO3 被还原,则生成了2 mol NO
-
除去下列物质中的杂质(括号中为杂质),所给出试剂或操作,正确的是( )
A. NaHCO3固体(Na2CO3),加热至固体质量不再改变
B. CO2(HCl),用氢氧化钠溶液洗气
C. NaHCO3 溶液(Na2CO3),通入过量 CO2
D. NaCl 固体(NH4Cl),加 NaOH 溶液后加热
-
R2O8n-在一定条件下可以把 Mn2+氧化为 MnO4-,若反应后 R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为 5:2,则 R2O8n-中 R 元素的化合价为( )
A. +7 B. +6 C. +3 D. +5
-
在常温下,发生下列几种反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-。根据上述反应,判断下列结论错误的是( )
A. 溶液中可发生:Z2+2A2+=2A3++2Z-
B. Z2在①、③反应中为还原剂
C. 氧化性强弱的顺序为:XO4->Z2>B2>A3+
D. X2+是XO4-的还原产物
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子