-
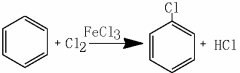
化学与生产、生活、社会密切相关,下列说法错误的是( )
A.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的单质或化合物
B.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质
C.臭氧、高锰酸钾溶液、次氯酸钠溶液、乙醇溶液均可用于消毒杀菌,且原理相同
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1molAlCl3在熔融状态时离子总数为0.4NA
B.2.2 g分子式为2H218O的水中含有的中子数为1.2NA
C.电解饱和食盐水时,当阴极产生H222.4L时,电路中转移的电子数为2NA
D.常温下pH=1的H2SO4溶液中,H+的浓度为0.2mol/L
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.114号元素在周期表中第七周期第VIA族,属于金属元素
B.晶体硅熔点高硬度大,可用于制作光导纤维
C.光束通过下列分散系①有尘埃的空气②胆矾溶液③墨水④稀豆浆时,均产生丁达尔效应
D.为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸
难度: 中等查看答案及解析
-
分子式为C8H10O的某芳香族化合物有多种结构,其中含有-CH2OH基团的有( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
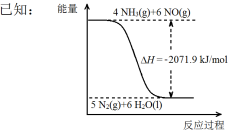
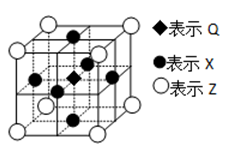
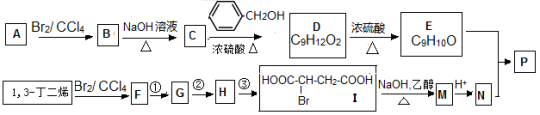
下列表述不正确的是( )

难度: 困难查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是( )
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.化合物AE与CE含有相同类型的化学键
D.含D的盐溶液既可能显酸性,也可能显碱性
难度: 困难查看答案及解析
-
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)向200ml上述溶液中加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是( )
A.c(CO32-)=0. 01mol•L﹣1,c(NH4+)<c(SO42-)
B.如果上述6种离子都存在,则c(Cl﹣)>c(SO42-)
C.一定存在SO42﹣、CO32﹣、NH4+,可能存在Cl﹣、Na+、K+
D.一定存在SO42﹣、CO32﹣、NH4+、Cl﹣,一定不存在Na+、K+
难度: 极难查看答案及解析