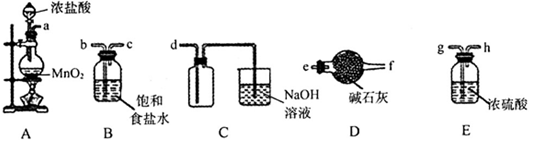
-
化学与生产和生活密切相关,下列说法正确的是
A.14C可用于文物年代的鉴定,是12C的同素异形体
B.向含重金属离子的工业废水中加入明矾,然后再将废水排放
C.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
D.配制氯化亚锡(SnCl2)溶液时需加适量盐酸目的是防止其被氧化变浑浊
难度: 中等查看答案及解析
-
已知A、B、C、D四种短周期元素,A、D同周期,B、C同主族,简单离子A+、D3+、B2-核外电子排布相同,则下列说法不正确的是:
A.气态氢化物的稳定性B>C
B.离子半径大小:B>A>D>C
C.A、C、D三种元素最高价氧化物对应的水化物能两两反应
D.A、B、C三种元素组成的化合物中含有离子键和共价键
难度: 中等查看答案及解析
-
下列叙述正确的是:
A.向FeCl3溶液中加入镁粉有气泡产生
B.NO2溶于水得到HNO3,所以NO2属于酸性氧化物
C.C12、SO2均能使品红溶液褪色,说明二者均有漂白性
D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
难度: 中等查看答案及解析
-
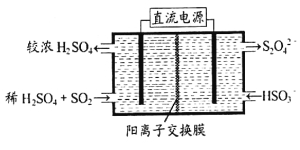
下列实验操作的叙述不正确的是:
A.中和滴定时,锥形瓶不用润洗
B.用试纸检验气体性质时,需先将试纸湿润,再检验
C.FeBr2溶液中通入少量Cl2,再加入CCl4,CCl4层不变色
D.向盐酸酸化的Ba(NO3)2溶液中通入SO2,不会产生沉淀
难度: 中等查看答案及解析
-
下列说法正确的是:
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
C.在c(H+)/c(OH-)= l012 溶液中 Na+、I-、NO3-、SO42-不能大量共存
D.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释
难度: 中等查看答案及解析
-
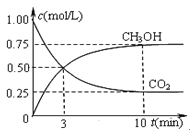
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:
I2(aq)+I-(aq)
I3-(aq),该反应的平衡常数与温度的关系如下图,下列说法错误的是
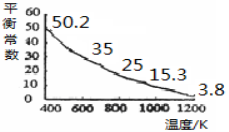
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
难度: 中等查看答案及解析
-
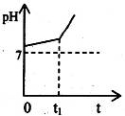
下列说法正确的是:
A.新制氯水中加入固体NaOH, 则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.25℃时,稀释0.5 mol·L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小
C.常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
难度: 中等查看答案及解析