-
下列电池不属于化学电池的是
A
B
C
D
铅蓄电池
太阳能电池
锌锰电池
镍镉电池




A. A B. B C. C D. D
难度: 中等查看答案及解析
-
图中所代表的反应属于吸热反应的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列防止金属腐蚀的方法属于电化学防护的是
A. 船体表面刷漆 B. 水中的钢闸门连接电源的负极
C. 自行车链条涂油 D. 加入铬、锰、硅等制成不锈钢
难度: 中等查看答案及解析
-
在一定温度下的密闭容器中,反应A(g)+B(g)
2C(g)达到平衡状态的标志是
A. 混合气体的质量不再发生变化
B. 容器内的总压强不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 单位时间内生成n mol A,同时消耗n mol B
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A. pH=7的溶液 B. 使酚酞溶液呈无色的溶液
C. c(H+)=c(OH-)的溶液 D. c(H+)=10-7 mol/L的溶液
难度: 简单查看答案及解析
-
碳酸氢钠可用于治疗胃酸过多症,在治疗期间,不宜过多食用的是
A. 米饭 B. 牛肉 C. 油菜 D. 米醋
难度: 中等查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A. 用H2O2制备氧气时加入MnO2
B. 开启易拉罐后,马上泛起大量泡沫
C. 配制FeCl3溶液时加入少量的盐酸
D. 相同温度时,AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
难度: 中等查看答案及解析
-
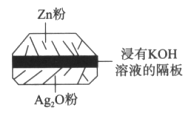
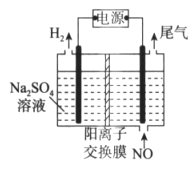
下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4
2PbSO4+2H2O,则下列说法正确的是
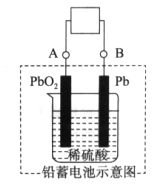
A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO
=PbSO4
难度: 中等查看答案及解析
-
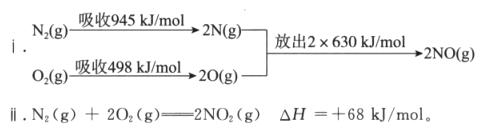
在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
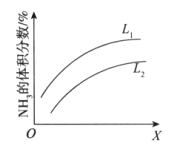
A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
难度: 中等查看答案及解析
-
已知水中存在电离平衡:H2O
H++OH-。下列说法正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中通入CO2,c(H+)增大,平衡向逆反应方向移动,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 中等查看答案及解析
-
室温条件下,下列实验可以证明甲酸(HCOOH)是弱电解质的是
①甲酸易挥发;②0.01 mol/L的甲酸钠溶液的pH大于7;③在相同条件下,0.01 mol/L甲酸的导电性比0.1 mol/L盐酸的弱;④0.01 mol/L的甲酸pH大于2。
A. ①② B. ②④ C. ③④ D. ①④
难度: 中等查看答案及解析
-
下图所示的实验,不能达到实验目的的是
A
B
C
D
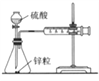
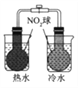
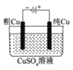
结合秒表测量锌与硫酸的反应速率
验证温度对化学平衡移动的影响
探究精炼铜的原理
证明酸性
CH3COOH>H2CO3>H3BO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是
A. 测0.1mol/L氨水的pH为11:NH3·H2O
NH
+OH-
B. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO
(aq)
SO
(aq)+CaCO3(s)
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
D. 使用碱性电解质的氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
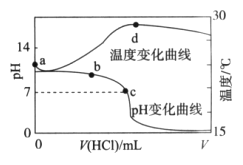
A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0
mol/L
C. b点:c(NH
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH
)
难度: 中等查看答案及解析
-
在一定条件下,N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是
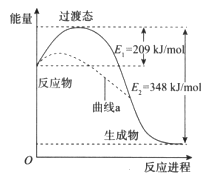
A. 该反应放出了348 kJ的热量
B. 曲线a可能是反应使用了催化剂
C. 断键吸收能量之和大于成键释放能量之和
D. N2O(g)+NO(g)=N2(g)+NO2(g)
=-139kJ/mol
难度: 中等查看答案及解析
-
五氯化磷(PCl5)是有机合成中重要的氯化剂,易发生PCl5(s)
PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A. 相同条件下,起始时向容器中充入2.0 mol PCl5,PCl5的分解率增大
B. 只升高温度,平衡时c(PCl5)=0.12 mol/L,则正反应是放热反应
C. 反应在前50 s的平均速率v(PCl3)=0.0032 mol/(L·s)
D. 在密闭低温的条件下,有利于PCl5固体的保存
难度: 中等查看答案及解析
-
室温下,向0.01 mol/L的醋酸溶液中,滴入1.00 mol/L、pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化如图所示。下列分析正确的是
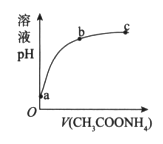
A. a点,pH=2
B. b点,c(CH3COO-)>c(NH
)
C. c点,pH可能大于7
D. ab段,醋酸溶液的稀释是溶液pH增大的主要原因
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的NO和足量C发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
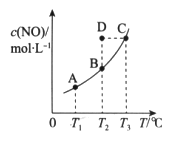
A. 增大压强或升高温度,NO转化率均增大
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
难度: 中等查看答案及解析
-
下列有关图像说法不正确的是
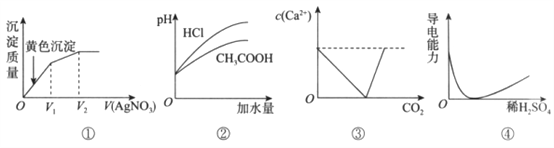
A. 图①:向等浓度的碘化钠和氯化钠的混合溶液中加入硝酸银溶液
B. 图②:向pH和体积均相同的盐酸和醋酸两种溶液中分别加水稀释
C. 图③:向饱和Ca(OH)2溶液中通入CO2
D. 图④:向Ba(OH)2溶液中加入稀H2SO4
难度: 中等查看答案及解析
-
某同学进行下列实验:
操作
现象
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水

放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
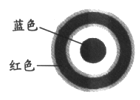
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈
难度: 中等查看答案及解析