-
以下反应属于吸热反应的是
A.锌与稀硫酸的反应 B.氯化铵与氢氧化钡晶体反应
C.煤的燃烧 D.氢氧化钠与盐酸的反应
难度: 简单查看答案及解析
-
1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是
它的中子数为( )
A. 80 B. 288 C. 208 D. 128
难度: 简单查看答案及解析
-
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是:
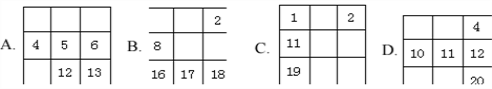
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列微粒半径大小比较正确的是
A. Na+<Mg2+<Al3+<O2- B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S D. Cs<Rb<K<Na
难度: 中等查看答案及解析
-
能说明A元素的非金属性比B元素的非金属性强的是( )
A. A原子得到电子的数目比B原子少
B. A元素的最高正价比B元素的最高正价要高
C. 气态氢化物的稳定性:A比B强
D. A单质能与B的氢化物水溶液反应,生成B单质
难度: 中等查看答案及解析
-
下列化合物中,同时含有离子键、非极性共价键的是:
A. NaOH B. H2O2 C. Na2O2 D. NaCl
难度: 中等查看答案及解析
-
下列表达方式错误的是
A.氟化钠的电子式
B.氯原子的结构示意图:
C.CO2分子的结构式:O=C=O D.甲烷的电子式
难度: 中等查看答案及解析
-
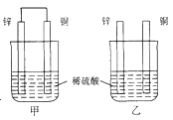
下列各个装置中能组成原电池的是:( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
难度: 中等查看答案及解析
-
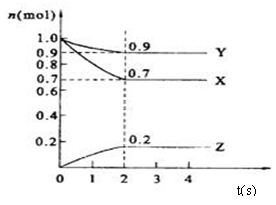
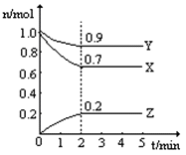
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是( )
A.1.5mol/(L.min) B.0.15mol/(L.min)
C.0.75mol/(L.min) D.0.075mol/(L.min)
难度: 中等查看答案及解析
-
下列递变规律正确的是:
A. HClO4、H2SO4、H3PO4的酸性依次增强
B. P、S、F最高正价依次升高
C. HCl、HBr、HI的稳定性依次增强
D. 锂、钠、钡的金属性依次增强
难度: 中等查看答案及解析
-
关于化学键的下列叙述中,正确的是:
A. 离子化合物可能含共价健。
B. 离子化合物中一定不含共价键,阳离子只能是金属离子。
C. 共价化合物可能含离子键。
D. 有化学键断裂就一定有化学键形成。
难度: 中等查看答案及解析
-
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一恒压密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生反应N2+3H2
2NH3 。下列有关说法正确的是:
A. N2完全转化为NH3时,即可视为达到化学平衡状态。
B. 达到化学平衡时,容器内压强和气体密度都不再变化。
C. 达到化学平衡时,反应则停止进行。
D. 达到化学平衡时,3ν(逆NH3)=2ν(正H2)
难度: 中等查看答案及解析
-
下列用电子式表示物质形成过程正确的是:
A.

B.

C.
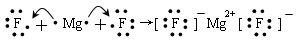
D.

难度: 简单查看答案及解析