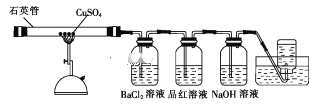
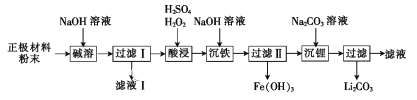
-
低碳环保的生活方式得到越来越多人的认同。下列做法值得提倡的是( )
A. 逢年过节,燃放大量烟花爆竹
B. 为方便出行,尽量使用私家车
C. 购物时使用布袋,少使用塑料袋
D. 冬季室内少穿衣服,调高空调温度
难度: 简单查看答案及解析
-
我国“复兴号”高速列车的运行速度达到350 km·h-1。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是( )
A. 铝合金 B. 铁合金
C. 碳素纤维 D. 硅纤维
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A. 氢化钠(NaH)中H的化合价:-1
B. 小苏打的化学式:Na2CO3
C. 氯离子的结构示意图:
D. NaClO的电离方程式:NaClO
Na++Cl-+O2-
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. 铁的强度大,可用铁罐贮运浓硫酸
B. 明矾溶液呈酸性,可用于净化水质
C. Al2O3熔点高,可用作耐高温材料
D. 浓硫酸具有强氧化性,可用于干燥CO2
难度: 中等查看答案及解析
-
下列物质属于电解质的是( )
A. 铝 B. 乙醇 C. 二氧化碳 D. 氯化钠
难度: 简单查看答案及解析
-
某溶液中存在大量的H+、Cu2+和Cl-,该溶液中还可能大量共存的离子是( )
A. OH- B. Ag+ C. HCO3- D. Fe2+
难度: 简单查看答案及解析
-
因反应物的用量、浓度或反应条件不同,下列各项中反应产物不同的是( )
A. Al2O3与NaOH B. Fe与Cl2
C. Cu与HNO3 D. NaHCO3与稀盐酸
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液与氨水反应:Al3++3OH-
Al(OH)3↓
B. 氧化镁与稀盐酸反应:MgO+2H+
Mg2++H2O
C. 铜与氯化铁溶液反应:2Fe3++3Cu
2Fe+3Cu2+
D. 稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+
BaSO4↓
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A. 吸收氯气
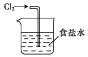 B. 蒸发食盐水
B. 蒸发食盐水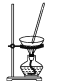
C. 制氨气
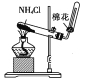 D. 制蒸馏水
D. 制蒸馏水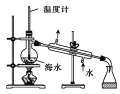
难度: 中等查看答案及解析
-
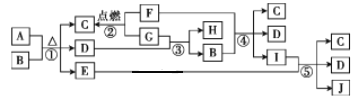
在给定条件下,下列选项中所示的物质间转化能一步实现的是( )
A. Fe
Fe2O3
Fe(OH)3
B. 稀盐酸
Cl2
NaCl
C. NH3
NO
NO2
D. SO2
(NH4)2SO4
BaSO4
难度: 中等查看答案及解析
-
二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
难度: 中等查看答案及解析