-
运用元素周期律分析下面的推断,其中不正确的是( )
A. 锂(Li)与水反应比钠与水反应剧烈
B. 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C. 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D. HBrO4的酸性比HIO4的酸性强
难度: 中等查看答案及解析
-
下列对化学反应的认识错误的是 ( )
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
难度: 简单查看答案及解析
-
下列化学用语表达正确的是:
A. HCl 的电子式:
B. F-结构示意图:
C. H2 燃烧的热化学方程式: 2H2 (g) + O2 (g) = 2H2O (g) △H = - 571.6 kJ·mol-1 D. Cl2 与水反应的离子方程式: Cl2 + H2O = 2H+ +Cl- + ClO-
难度: 简单查看答案及解析
-
下列说法不正确的是:
A. 全由非金属元素构成的化合物中可能含有离子键
B. 某些分子中可能不存在任何化学键
C. 离子键和共价键可能同时存在于同一化合物中
D. 非极性键可能由不同元素的原子形成
难度: 中等查看答案及解析
-
某粒子用
表示,下列关于该粒子的叙述中正确的是:
A. 所含质子数=A-n B. 所含中子数=A-Z
C. 所含电子数=A+n D. 所含质子数=A+Z
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是:
A. 能与水反应生成碱的金属元素都在 IA 族
B. 原子序数为奇数的元素其族序数都为奇数
C. 非金属元素都位于周期表中的主族和 0 族
D. 粒子的核外电子层数等于该元素所在周期数
难度: 中等查看答案及解析
-
下列各图为周期表中的一部分,原子序数与其位置不相符的是:
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列各组物质中所含共用电子对数相同的组合是:
A. NH3、H2O B. H2O2、CO2 C. CH4、CCl4 D. H2、N2
难度: 简单查看答案及解析
-
下列反应过程中的能量变化符合图的是:
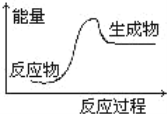
①酸碱中和;②镁与盐酸的反应;③生石灰变成熟石灰的反应;④铝热反应;⑤石灰石分解;⑥甲烷燃烧;⑦灼热的炭与二氧化碳反应
A. ①②③⑤ B. ④⑤⑦ C. ③④⑦ D. ⑤⑦
难度: 简单查看答案及解析
-
下列实验现象与结论不正确的是:
A. 向某无色溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀则说明溶液中存在Cl-
B. 金属钠在氯气中燃烧产生白烟,火焰呈黄色
C. 将光亮的镁条放入水中加热至沸腾,滴入酚酞后呈红色
D. 将少量氯水滴入KI 溶液中充分振荡,再加入少量CCl4,振荡后溶液分层,下层呈紫色
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是:
A. 除了K层以外,其它电子层最多只能容纳8 个电子
B. ⅠA 族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同数目的质子和中子
D. 元素的非金属性越强,其含氧酸的酸性越强
难度: 中等查看答案及解析
-
下列关于热化学方程式的说法中正确的是:
A. 热化学方程式只表明了化学反应吸收或放出热量的多少
B. 热化学方程式的化学计量数表示物质的量,可以不是整数
C. 热化学方程式中的△H 只与反应条件有关,与物质状态无关
D. 热化学方程式只能表示化学反应中的能量变化,不能表示物理变化中的能量变化
难度: 简单查看答案及解析
-
设NA 为阿伏加德罗常数,下列说法中正确的是:
A. 78gNa2O2 含有阴阳离子总数为 4NA
B. 1.7g NH2— 离子中所含的电子数为NA
C. 标况下 2.24LHCl 气体中含有 0.1molH+
D. 20gD216O 中含有的中子数目为 10NA
难度: 困难查看答案及解析
-
某元素X 的最高价含氧酸的化学式为 HnXO2n-2,则在某气态氢化物中,X 元素的化合价为:
A. 5n-12 B. 3n-12 C. 3n-6 D. n-10
难度: 中等查看答案及解析
-
同周期的X,Y,Z 三种元素,已知最高价氧化物的水化物酸性由强到弱的顺序如下:HXO4>H2YO4>H3ZO4,则下说法不正确的是:
A. 原子半径:Z>Y >X
B. 简单阴离子半径按 X,Y,Z 顺序依次增大
C. 非金属性:X>Y>Z
D. 氢化物稳定性按 X,Y,Z 顺序逐渐增强
难度: 中等查看答案及解析
-
已知破坏1molH-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1 molHCl总的过程需要( )
A. 放热185kJ B. 吸热185kJ C. 放热92.5 kJ D. 吸热92.5 kJ
难度: 简单查看答案及解析
-
已知在 100kPa 时,C(石墨)→C(金刚石) ΔH= +1.9 kJ/mol,下列说法正确的是:
A. C(石墨)转化为C(金刚石)的过程中只有化学键的断裂,没有新化学键形成
B. 等质量的石墨和金刚石分别完全燃烧,相同条件下前者放出的热量多
C. 等质量的石墨和金刚石在完全燃烧时破坏共价键需要吸收的能量不相等
D. 由此可知金刚石比石墨稳定
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的 3 倍,Y 原子的最外层只有 2 个电子,Z 单质可制成半导体材料,W 与X 属于同一主族。下列叙述正确的是:
A. 元素X 的简单气态氢化物的热稳定性比W 的强
B. 元素W 的最高价氧化物对应水化物的酸性比 Z 的弱
C. 化合物YX、ZX2、WX3 中化学键的类型相同
D. 原子半径的大小顺序: r(W) > r(X) > r(Z) > r(Y)
难度: 简单查看答案及解析