-
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,W与X可形成一种红棕色有刺激性气味的气体,Y的原子半径是所有短周期主族元素中最大的,Z原子最外层电子数与W原子的电子总数相同。下列说法中正确的是
A. W的氧化物对应水化物均为强酸
B. 简单离子半径:W<X<Y
C. 简单氢化物沸点:Z<W
D. Y与Z形成的化合物的水溶液呈碱性
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应;②“乙醇汽油”是在汽油中加入适量乙醇而制成的一种燃料,它是一种新型化合物;③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液;④石油的分馏和煤的气化都是发生了化学变化;⑤淀粉遇碘酒变蓝色,在加热条件下,葡萄糖能与新制Cu(OH)2悬浊液发生反应;⑥塑料、橡胶和纤维都是合成高分子材料;
A. ③④⑤ B. ①②⑥ C. ①③⑤ D. ②③④
难度: 中等查看答案及解析
-
化学与人类生产、生活、科研密切相关,下列有关说法正确的是
A. 新能源汽车的推广使用有助于减少光化学烟雾
B. 黑火药燃烧反应时,氧化剂只是单质硫
C. “侯氏制碱”中的“碱”不属于碱,而是盐NaHCO3
D. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA,下列说法正确的是
A. 1 L 1 mol/L葡萄糖溶液含有氧原子数为6NA
B. 氯气通入到含有1mol的FeBr2溶液中,当有NA个Br-被氧化时,共消耗标准状况下氯气22.4L
C. 标准状况下,2.24 L HF中所含质子数目为NA
D. 4.4 g由14CO2与14N2O组成的混合物中所含中子数为2.2NA
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论或解释正确的是
选项
实验操作和现象
结论或解释
A
向含有酚酞的Na2SO3溶液中加入少量BaCl2固体,产生白色沉淀,溶液红色变浅
Na2SO3溶液中存在水解平衡
B
将SO2气体通入用盐酸酸化的KMnO4溶液中,紫红色褪去
SO2有还原性和漂白性
C
向2mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1FeCl3溶液3mL,充分振荡,用苯萃取多次后,上层呈紫红色,取下层滴加5滴KSCN溶液,出现血红色
FeCl3溶液与KI溶液的反应是可逆反应
D
CH3CH2Br与NaOH溶液混合,共热并充分振荡,冷却后滴加硝酸银溶液,未出现淡黄色沉淀
CH3CH2Br是非电解质,不与氢氧化钠反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
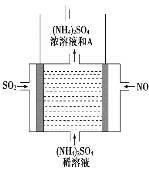
新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。
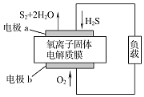
下列说法正确的是
A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
难度: 困难查看答案及解析
-
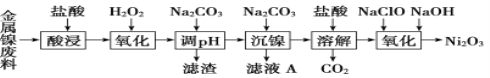
MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
难度: 困难查看答案及解析
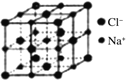
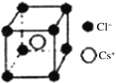
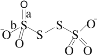 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。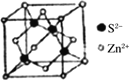
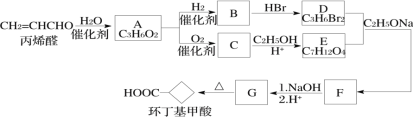
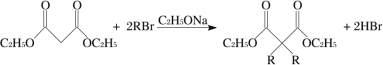
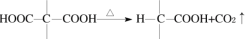
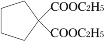 ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。