-
下列各组中两种微粒所含电子数不相等的是
A. H3O+和OH- B. CO和N2 C. HNO2和NO2- D. CH3+和NH4+
难度: 简单查看答案及解析
-
某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( )
A. 一定是离子键
B. 一定是共价键
C. 可能是离子键也可能是共价键
D. 以上说法都不正确
难度: 中等查看答案及解析
-
在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是
A. 任何化学反应都伴随着能量的变化
B. 因地制宜开发利用风能、水能、地热能、潮汐能
C. 若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
D. 煤、石油天然气均为化石能源,是可再生能源
难度: 中等查看答案及解析
-
决定元素种类的因素是
A. 核外电子数 B. 最外层电子数 C. 核电荷数 D. 中子数
难度: 简单查看答案及解析
-
下列叙述错误的是
A. 16O和18O属于同一种元素,它们互为同素异形体
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,它们互为同位素
难度: 中等查看答案及解析
-
关于化学电源的叙述,错误的是
A. 化学电源是根据原电池的工作原理设计的
B. 在干电池中,碳棒作正极,并不参与化学反应
C. 镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵
D. 铅蓄电池是一种二次电池,其中铅作电池的负极材料
难度: 中等查看答案及解析
-
某微粒用
表示,下列关于该微粒叙述正确的是
A. 质量数=A-n B. 中子数=A-Z
C. 电子数=Z+n D. 质子数=A+Z
难度: 中等查看答案及解析
-
下列叙述错误的是
A. 核外电子总是优先排在能量最低的电子层上
B. 原子及其离子的核外电子层数等于该元素所在的周期数
C. 元素周期表中从IIIB到IIB族10个纵行的元素都是金属元素
D. 除氦以外的稀有气体原子的最外层电子数都是8
难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是
A. Ba(OH)2 B. H2SO4 C. HCl D. MgCl2
难度: 中等查看答案及解析
-
下列有关电子式的书写正确的是
A. N2 的电子式:
B. NH4Cl 的电子式:
C. HClO 的电子式:
D. CO2 的电子式:
难度: 中等查看答案及解析
-
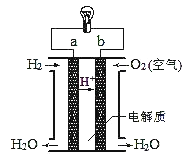
下列各装置能形成原电池的装置是
A.
B.
C.

D.

难度: 中等查看答案及解析
-
某学生用如图所示装置进行化学反应X+Y===M+N能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处升、乙处降。关于该反应的下列叙述正确的是

A. X的能量一定低于M的,Y的能量一定低于N的
B. 该反应为吸热反应,一定要加热反应才能进行
C. X和Y的总能量一定低于M和N的总能量
D. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
难度: 中等查看答案及解析
-
如图表示碱金属的某些性质与核电荷数的变化关系,则下列性质中不符合图示关系的是
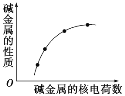
A. Na的熔点比钾的高
B. K与H2O的反应比Na剧烈
C. K在O2中燃烧的产物更为复杂
D. KOH的碱性比NaOH强
难度: 中等查看答案及解析
-
由
和
组成的5.5 g水中,含有的中子的物质的量是
A. 2 mol B. 2.5 mol C. 3 mol D. 3.5mol
难度: 中等查看答案及解析
-
有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是
A. b-a=n+m
B. a-b=n-m
C. 核电荷数Y<X
D. 原子半径Y>X
难度: 中等查看答案及解析
-
已知某非金属元素X的氢化物化学式为H2X,则其最高价氧化物对应水化物的化学式是
A. HXO4 B. H2XO4 C. HXO3 D. H2XO3
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。则下列说法不正确的是
A. M形成的简单离子的半径小于Z的形成的简单离子的半径
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期第ⅥA族
难度: 中等查看答案及解析
-
下列关于元素周期表和元素周期律的说法错误的是
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Na比K容易失去电子,所以Na比K的还原性强
D. O与S为同主族元素,且O比S的非金属性强
难度: 简单查看答案及解析
-
X、Y、Z是三种短周期元素,其中X、Y位于同一族,Y、Z位于同一周期。X原子的最外层电子数是电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法不正确的是
A. 元素非金属性由弱到强的顺序为Z<Y<X
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 三种元素的气态氢化物中,X的气态氢化物最稳定
D. Y的一种氧化物可以作漂白剂
难度: 中等查看答案及解析
-
对于元素周期表,下列叙述中不正确的是
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C. 在金属元素区域可以寻找制备新型农药材料的元素
D. 元素周期表中位置靠近的元素性质相近
难度: 简单查看答案及解析
-
下列说法正确的是
A. 破坏化学键的过程,一定是化学变化过程
B. NaOH熔化时,既破坏了离子键又破坏了共价键
C. 反应H2+Cl2
2HCl破坏了共价键,形成了共价键
D. 17Cl和18Cl的相互转化属于化学变化
难度: 中等查看答案及解析
-
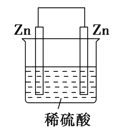
如图为某兴趣小组制作的番茄电池,下列说法正确的是

A. 电子由锌通过导线流向铜
B. 该装置将电能转化为化学能
C. 锌电极发生还原反应
D. 铜电极上无气泡产生
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是
A. 原子半径:Na > Mg > Al > H
B. 热稳定性: HCl < H2S < PH3
C. 酸性强弱:H2SiO3 < H2CO3 < H3PO4
D. 氧化性:K+ < Na+ < Mg2+ < Al3+
难度: 中等查看答案及解析
-
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),质子数为(2n2一1)。下列关于元素X的说法中,不正确的是( )
A. 其最高化合价一定为+5
B. 可以形成化学式为KXO3的盐
C. 其氢化物可以用来做喷泉实验
D. 其最高价氧化物的水化物是强酸
难度: 中等查看答案及解析
-
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
A. 通CO的一极是电子流出的一极,发生氧化反应
B. 该电池在常温下工作
C. 负极反应式为:O2+2CO2+4e-==2CO32-
D. 电池工作时CO32-向正极移动
难度: 中等查看答案及解析