-
下列有关元素周期表的说法正确的是( )
A. Li是最活泼金属,F是最活泼非金属
B. 在周期表中金属与非金属的分界处,可找到做催化剂的材料
C. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. 同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
难度: 简单查看答案及解析
-
1934年居里夫妇用α粒子(4He)轰击27Al 得到一种自然界不存在的磷元素的一种同位素(3015P):2713Al+42He
3015P+10n,开创了人造核素的先河。下列有关说法不正确的是
A. 该变化说明原子核在一般的化学反应中也能发生变化
B. 该变化同样遵循质量守恒定律
C. 10n是一种电中性粒子
D. 对于3015P有:原子序数=质子数=中子数=核外电子数
难度: 简单查看答案及解析
-
下列化学用语或图示表达不正确的是( )
A. CO2的电子式:
B. NH3的结构式为:
C. CH4的比例模型:
 D. Clˉ离子的结构示意图:
D. Clˉ离子的结构示意图:难度: 中等查看答案及解析
-
下列关于能源和作为能源使用的物质的叙述中,错误的是
A.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
B.太阳能不能直接转化为电能
C.物质的化学能可以在不同条件下转化为热能、电能等为人类所用
D.绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来
难度: 简单查看答案及解析
-
根据相关的化学原理,下列判断正确的是( )
A. 由于水中存在氢键,所以稳定性:H2O>H2S
B. 由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C. 若A2+2D﹣═2A﹣+D2,则氧化性D2>A2
D. 若R2﹣和M+的电子层结构相同,则离子半径R2﹣>M+
难度: 简单查看答案及解析
-
下列说法正确的是
A. 由C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 在一定条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的标准燃烧热为110.5 kJ·mol-1
D. 在一密闭容器中,9.6 g的硫粉与11.2 g的铁粉混合加热,充分反应,生成硫化亚铁17.6 g,放出19.12 kJ的热量,则Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
难度: 中等查看答案及解析
-
右图是铝热反应(2Al+Fe2O3
Al2O3+2Fe)的实验装置,有关该反应的下列说法中正确的是( )
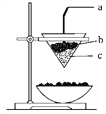
A. a为镁条
B. b为氧化铁与铝粉的混合物
C. 2 mol氧化剂参与反应则电子转移6NA个
D. 还原剂与氧化产物的物质的量之比为1∶2
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq)
 AlCl3
AlCl3Al
② NH3
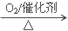 NO
NO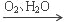 HNO3
HNO3③NaCl(饱和)
 NaHCO3
NaHCO3Na2CO3
④FeS2
SO3
H2SO4
A. ②③ B. ①④ C. ②④ D. ③④
难度: 中等查看答案及解析
-
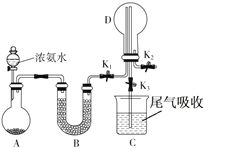
对下列实验装置图中所示的实验操作评价合理的是
A.
 可能证明非金属性强弱:Cl>C>Si
可能证明非金属性强弱:Cl>C>SiB.
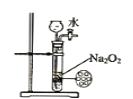 装置可用来制备少量氧气,并且控制反应的发生与停止
装置可用来制备少量氧气,并且控制反应的发生与停止C.
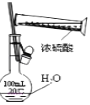 配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行
配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行D.
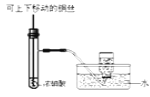 制备并收集少量NO2气体
制备并收集少量NO2气体难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层电子都符合相应稀有气体原子的结构,则下列有关说法中,不正确的是
A. NH5中既有离子键又有共价键
B. NH5的熔沸点高于NH3
C. NH5固体投入少量水中,可产生两种气体
D. 0.1 mol NH5中含有0.5 mol N—H键
难度: 中等查看答案及解析
-
下列有关于中和热测定的说法正确的是( )
A. 50mL0.50mol·L-1的盐酸和50mL0.50mol·L-1的氢氧化钠溶液反应放出的热量即为中和热
B. 在实验中,向盛盐酸的简易量热计中加氢氧化钠溶液时,要缓慢、分多次加入
C. 在实验操作时,使用环形玻璃搅拌棒既可以搅拌充分又可以避免损坏温度计
D. 在没有盐酸的情况下,若改用浓硫酸做此实验,得到的△H值偏大
难度: 简单查看答案及解析
-
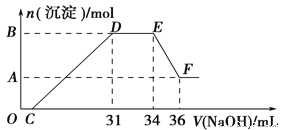
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
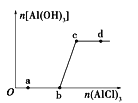
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:K+、Ag+、Ca2+、NO3-
D. d点对应的溶液中:K+、NH4+、CO32-、SO42-
难度: 中等查看答案及解析
-
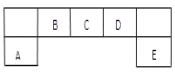
R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍。下列推断正确的是( )
R
X
Y
Z
A
A. 气态氢化物的热稳定性由强到弱的顺序为:Z>R>X>Y
B. 原子半径由小到大的顺序为:Z<A<Y<X
C. 最高价氧化物对应的水化物酸性由弱到强的顺序为:Z<R<A
D. A2X、ZA5分子中每个原子最外层都达到8电子结构
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 硅和C60的熔化克服相同类型作用力
B. 只有活泼金属元素与活泼非金属元素之间才能形成离子键
C. 等物质的量的CN-和N2含有的共用电子对数相等
D. 氯气与NaOH溶液反应的过程中,同时有离子键、极性键与非极性键的断裂和形成
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24 LCCl4中碳氯键的数目为0.4 NA
B. 1 L 0.1 mol·Lˉ1硫酸铝溶液中含有的氧原子数为1.2NA
C. 标准状况下,8.96 L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA
D. 1.2 g金刚石与石墨混合物中含有碳碳单键的数目为0.4NA
难度: 中等查看答案及解析
-
根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A. △H=+244.1 kJ·mol-1 B. △H=-488.3 kJ·mol-1
C. △H=-996.6 kJ·mol-1 D. △H=+996.6 kJ·mol-1
难度: 简单查看答案及解析
-
在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mL B. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3 D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是
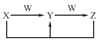
A. X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素
B. 物质W可能是化合物,也可能是单质
C. 上述转化关系中不可能出现置换反应
D. 若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱
难度: 中等查看答案及解析
-
有A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
A. 若B(OH)m是强碱,则A(OH)m一定为强碱
B. 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸
C. 若B是金属,则A可能是非金属,若B是非金属,则A可能是金属
D. 常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体
难度: 简单查看答案及解析
-
某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成的,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
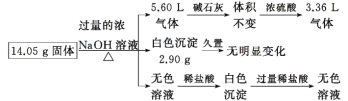
下列说法中不正确的是
A. 该固体中一定没有FeCl2,可能含有AlCl3 B. 该固体中含有2.70 g Al
C. 该固体中含有6.60 g (NH4)2SO4 D. 该固体中含有4.75 g MgCl2
难度: 中等查看答案及解析