-
在科学史上每一次重大的发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于
A. 开发了合成氨的生产工艺
B. 提出了元素周期律
C. 揭示了燃烧的本质
D. 提取了治疟药物青蒿素
难度: 简单查看答案及解析
-
在短周期元素中,原子最外电子层只有1个或2个电子的元素
A. 是非金属元素 B. 是稀有气体元素 C. 是金属元素 D. 无法确认为哪一类元素
难度: 中等查看答案及解析
-
下列物质中含有共价键的是
A. HCl B. NaCl C. MgO D. KI
难度: 中等查看答案及解析
-
下列物质互为同分异构体的一组是
A. 水和过氧化氢 B. 12C与14C C. 正丁烷和异丁烷 D. O2和O3
难度: 简单查看答案及解析
-
在2A + B
3C + 4D 反应中(各物质均为气体),表示该反应速率最快的是
A. v(A)= 0.5 mol·L-1·s-1
B. v(B)= 0.3 mol·L-1·s-1
C. v(C)= 0.8 mol·L-1·s-1
D. v(D)= 30 mol·L-1·min-1
难度: 中等查看答案及解析
-
常温下,用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是
A. 水浴加热
B. 加水稀释
C. 滴加少许CuSO4溶液
D. 改用铁粉并振荡
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A. 氯气的电子式:
B. 氮气的结构式:∶N≡N∶
C. F一的结构示意图:
D. H2O2的电子式:
难度: 中等查看答案及解析
-
以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是
A. NH3

B. H2O

C. HCl

D. CCl4

难度: 简单查看答案及解析
-
下列变化中,需要吸收热量用于克服分子间作用力的是
A. 干冰置于空气中升华 B. 加热使石英熔化
C. 将食盐溶解于水 D. 加热使硫化氢分解
难度: 简单查看答案及解析
-
医学研究证明,用放射性
治疗肿瘤可收到一定疗效。下列有关
叙述正确的是
A.
是碘的一种同素异形体
B.
是一种新发现的元素
C.
位于元素周期表中第四周期第VIIA族
D.
核内的中子数与核外电子数之差为29
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 吸热反应不加热不可能进行反应
B. 放热反应在常温下一定很容易发生
C. 需要加热才能发生的反应一定是吸热反应
D. 反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的
难度: 中等查看答案及解析
-
下列事实与氢键有关的是
A. 水分解成氢气和氧气吸收热量
B. 水结成冰体积膨胀,密度变小
C. 水加热到很高的温度都难以分解
D. HF、HCl、HBr、HI的热稳定性依次减弱
难度: 困难查看答案及解析
-
当其他条件不变时,下列说法正确的是
A. 使用催化剂一定能加快反应速率
B. 用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率
C. 在N2+3H2
2NH3反应中,增大N2浓度一定可以使H2全部转化为NH3
D. 当反应物与生成物浓度相等时,可逆反应一定己达到化学反应限度
难度: 中等查看答案及解析
-
关于元素周期表的说法正确的是
A. 元素周期表有8个主族
B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期
D. 短周期是指第一、二周期
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A. 金属钠与水反应 B. 甲烷在空气中燃烧
C. 盐酸与氢氧化钠溶液反应 D. 石灰石高温分解
难度: 简单查看答案及解析
-
反应2SO2+O2
2SO3经一段时间后,O2的浓度减小了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
A. 0.1s B. 2.5s C. 5s D. 10s
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是
A. 2H2O (g) =2H2(g)+O2(g)
B. 2H2(g)+O2(g) = 2H2O(l) △H=-571.6 kJ/mol
C. 2SO2 + O2 = 2SO3 △H=-196.6 kJ/mol
D. C(s) + O2(g) = CO2(g) △H= +393.5 kJ/mol
难度: 中等查看答案及解析
-
在密闭系统中有反应C(s)+CO2(g)
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥ B. ①②④⑥ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是
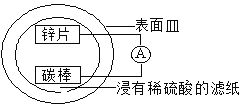
A. 锌片作正极
B. 碳棒上有气泡产生
C. 可将电能转化为化学能
D. 电子由碳棒经导线流向锌片
难度: 中等查看答案及解析
-
元素R、T、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A. 原子半径 Z>Y>R B. R与Y的电子数相差8
C. 非金属性:Z>Y>X D. HZO4是目前无机酸中最强的含氧酸
难度: 中等查看答案及解析
-
在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g)
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO2速率是O2速率的2倍
B. SO3的浓度是O2浓度的2倍
C. SO3的质量分数保持不变
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
难度: 中等查看答案及解析
-
据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如图:下列说法中正确的是
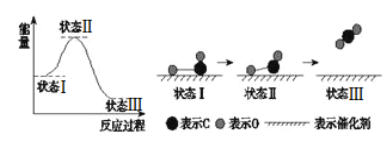
A. 状态Ⅰ→状态Ⅲ是放热过程
B. 该过程中,CO先断键形成C和O,再生成CO2
C. 状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2
D. 状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用
难度: 中等查看答案及解析
-
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的稳定性为H2T<H2R
B. 单质与稀盐酸反应的剧烈程度为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析