-
下列物质的酸性强弱比较中,错误的是( )
A. HClO4>HBrO4>HIO4 B. HClO4>H2SO4>H3PO4
C. HClO4>HClO3>HClO D. H2SO3>H2SO4>H2S2O3
难度: 简单查看答案及解析
-
下列原子中未成对电子数最多的是( )
A. C B. O C. N D. Cl
难度: 中等查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是 ( )
A. SiO2CsCl CBr4CF4 B. SiO2CsCl CF4CBr4
C. CsCl SiO2CBr4CF4 D. CF4CBr4CsCl SiO2
难度: 中等查看答案及解析
-
下列有关晶体和非晶体的说法中正确的是( )
A. 具有规则几何外形的固体均为晶体
B. 晶体具有自范性,非晶体没有自范性
C. 晶体研碎后即变为非晶体
D. 将玻璃加工成规则的固体即变成晶体
难度: 简单查看答案及解析
-
下列物质的分子中,键角最大的是
A. H2O B. BF3 C. CH4 D. NH3
难度: 中等查看答案及解析
-
下列各组分子中都属于含极性键的非极性分子的是( )
A. CO2、H2S B. C2H4、CH4 C. Cl2、C2H2 D. NH3、HCl
难度: 中等查看答案及解析
-
在下列有关晶体的叙述中错误的是 ( )
A. 离子晶体中,一定存在离子键 B. 原子晶体中,只存在共价键
C. 金属晶体的熔沸点均很高 D. 稀有气体的原子能形成分子晶体
难度: 简单查看答案及解析
-
下列哪些性质不能区别晶体与玻璃体( )
A. 各向异性 B. X-射线衍射
C. 导电性 D. 有无固定的熔点
难度: 简单查看答案及解析
-
下列关于晶体的性质叙述中,不正确的是( )
A. 晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体几何外形
B. 晶体的各向异性和对称性是矛盾的
C. 晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D. 晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
难度: 中等查看答案及解析
-
下列物质固态时一定是分子晶体的是( )
A.酸性氧化物 B.碱性氧化物 C.含氧酸 D.非金属单质
难度: 中等查看答案及解析
-
在下列三种晶体:①金刚石,②晶体硅,③碳化硅中,它们的熔点从高到低的顺序是( )
A. ①③② B. ②③①
C. ③①② D. ②①③
难度: 简单查看答案及解析
-
符号为K的能层最多能容纳的电子数为( )
A. 2 B. 32
C. 50 D. 72
难度: 简单查看答案及解析
-
下列有关金属键的叙述错误的是( )。
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C. 金属键中的电子属于整块金属
D. 金属的性质和金属固体的形成都与金属键有关
难度: 中等查看答案及解析
-
关于体心立方堆积晶体(如图)结构的叙述中正确的是 ( )

A.是密置层的一种堆积方式 B.晶胞是六棱柱
C.每个晶胞内含2个原子 D.每个晶胞内含6个原子
难度: 简单查看答案及解析
-
下列3d能级的电子排布图正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列物质分子中无π键的是( )
A. N2 B. O2 C. Cl2 D. C2H4
难度: 中等查看答案及解析
-
下列说法中正确的是
A.p轨道之间以“肩并肩”重叠可形成σ键
B.p轨道之间以“头对头”重叠可形成π键
C.s和p轨道以“头对头”重叠可形成σ键
D.共价键是两个原子轨道以“头对头”重叠形成的
难度: 简单查看答案及解析
-
下列说法中错误的是
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
难度: 简单查看答案及解析
-
有关晶体的下列说法中正确的是( )
A. 分子晶体中共价键越强,熔点越高
B. 原子晶体中分子间作用力越强,熔点越高
C. 氯化钠晶体熔化时离子键发生断裂
D. 金属晶体熔化时金属键未发生断裂
难度: 中等查看答案及解析
-
金属能导电的原因是( )
A. 金属晶体中金属阳离子与自由电子间的相互作用较弱
B. 金属晶体中的自由电子在外加电场作用下可发生定向移动
C. 金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D. 金属晶体在外加电场作用下可失去电子
难度: 简单查看答案及解析
-
金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是( )
A. Li Na K B. Na Mg Al
C. Li Be Mg D. Li Na Mg
难度: 中等查看答案及解析
-
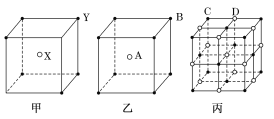
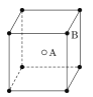
根据晶体中晶胞的结构,判断下列晶体的化学式不正确的是( )
A. AB2
 B. C2D
B. C2D C. EF
C. EF 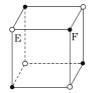 D. XY3Z
D. XY3Z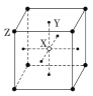
难度: 简单查看答案及解析
-
下列分子中,既含有σ键又含有π键的是
A. CH4 B.NH3 C.CO2 D.F2
难度: 简单查看答案及解析
-
下列配合物中,配位数错误的是( )
A. K[Ag(CN)2]: 2 B. [Ni(NH3)4]Cl2: 4
C. [Ag(NH3)2]Cl: 3 D. [Ag(NH3)2]Cl:2
难度: 简单查看答案及解析
-
关于CO2说法正确的是 ( )
A. 碳原子采取sp3杂化 B. CO2是直线形结构
C. C-O键为非极性键 D. CO2为极性分子
难度: 中等查看答案及解析
-
如图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

A. H2S B. HCl C. PH3 D. SiH4
难度: 中等查看答案及解析
-
以下事实中不能用“相似相溶”原理说明的是( )
A. HCl易溶于水 B. I2易溶于CCl4中
C. Cl2可溶于水 D. NH3难溶于苯中
难度: 简单查看答案及解析
-
下列分子中含有手性碳原子的是( )
A. CH2Cl2 B.
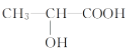
C.
D. CH3CH2COOCH2CH3
难度: 中等查看答案及解析
-
基态硅原子的最外能层的各能级中,电子排布的方式正确的是( )
A.
B.
C.
D.

难度: 中等查看答案及解析