-
下列食品、调味品的制作过程中,没有发生化学变化的是



A.鲜奶制酸奶 B.黄豆酿酱油 C.糯米酿甜酒 D.水果榨果汁
难度: 中等查看答案及解析
-
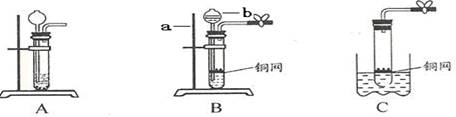
下列玻璃仪器中,可以直接在酒精灯火焰上加热的是

难度: 中等查看答案及解析
-
一种“环保石头纸”在2011年的两会上以便签、文件袋等形式再次亮相。“环保石头纸”的主要原料是碳酸钙和高分子材料。“环保石头纸”属于
A.单质 B.化合物 C.混合物 D.纯净物
难度: 中等查看答案及解析
-
下列关于氧气的说法中,错误的是
A.氧气用于炼钢,目的是除去生铁中多余的碳和其他杂质
B.氧气可以支持燃烧,说明氧气具有可燃性
C.氧气可以供给呼吸,是因为和体内物质反应而释放能量,维持生命活动
D.夏天鱼池内放增氧泵,是因为温度升高,氧气在水中溶解量减少
难度: 中等查看答案及解析
-
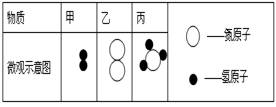
下列微观粒子示意图中(不同的小球代表不同的原子),能用来表示3个氢气分子的是

难度: 中等查看答案及解析
-
我市市区的道路两侧使用了一些太阳能路灯(如下图所示)。

关于太阳能路灯所用材料的叙述不正确的是
A铝合金灯柱属于金属材料
B.单质硅电池板属于无机非金属材料
C.透明的塑料灯罩属于有机合成高分子材料
D.灯泡中填充氮气做保护气
难度: 中等查看答案及解析
-
下列图示的各物质(或元素)相对含量错误的是

难度: 中等查看答案及解析
-
在细菌作用下,用氨处理含甲醇(CH3OH)的工业废水,使其变成无毒的N2和CO2,从而消除对环境的污染,化学反应为:6NH3+5CH3OH+12A=3N2+5CO2+19H2O,则A物质的化学式为
A.H2 B.CO
C.O2 D.NO
难度: 中等查看答案及解析
-
下列图示的实验操作中,正确的是
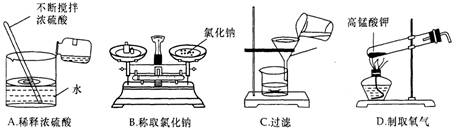
难度: 中等查看答案及解析
-
低碳生活已经成为人们所追求的目标。“低碳生活”简言之就是减低二氧化碳的排放,就是低能量、低消耗、低开支的生活方式。下列做法不符合低碳生活方式的是
A.骑自行车上学 B.用淘米水浇花
C.多用相对廉价的煤 D.减少使用塑料袋
难度: 中等查看答案及解析
-
下列各项中,前者一定大于后者的是
A.20℃时KNO3的溶解度、80℃时KNO3的溶解度
B.30℃时NaCl不饱和溶液的质量分数、30℃时NaCl饱和溶液的质量分数
C.碳酸镁中碳元素的质量分数、碳酸氢钠中碳元素的质量分数
D.相同条件下:NaOH溶于水后溶液的温度、NH4NO3溶于水后溶液的温度
难度: 中等查看答案及解析
-
2011年央视《每周质量报告》的3·15特别节目曝光:河南生猪主产区采用违禁药品瘦肉精,有毒猪肉流向双汇分公司。“瘦肉精“的化学式C12H19Cl3N2O,则下列有关瘦肉精的说法不正确的是
A.瘦肉精分子中含有氮分子
B.瘦肉精由碳、氢、氧、氯、氮五种元素组成
C.每个瘦肉精分子由37个原子构成
D.瘦肉精中质量分数最大的是碳元素
难度: 中等查看答案及解析
-
科学家用单个分子制成了“纳米车”,它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物的过程是肉眼能够直接看见的
D.“纳米车”研制成功说明,在一定条件下人可以控制分子运动
难度: 中等查看答案及解析
-
我国科学家在CO低温氧化的研究上取得了突破性进展。利用四氧化三钴纳米棒,可将汽车尾气中的CO在低温下与氧气反应转化为CO2,示意图如下。下列关于该转化的几点说法,不正确的是
A.反应前后氧原子数不发生变化
B.反应中CO与O2的质量比为7:4
C.四氧化三钴纳米棒可能是反应的催化剂
D.反应前后分子的数目没有发生改变,分子的种类一定发生改变
难度: 中等查看答案及解析
-
小林同学对所学知识归纳如下,其中有错误的一组是
A.化学与能源
B.安全知识
煤、石油、天然气——不可再生的化石燃料
风能、水能、太阳能——未充分利用的绿色能源
居室装修——常开窗通风,使有害物挥发
煤气泄漏——关闭气阀、严禁烟火
C.元素与人体健康
D.环保与物质利用
缺钙——易得甲状腺肿大
缺氟——易生龋齿
减少水污染——合理使用农药、化肥
减少白色污染——使用可降解的塑料
难度: 中等查看答案及解析
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:

该方案的主要目的是为了制备
A.HBr B.CaO
C.H2 D. Hg
难度: 中等查看答案及解析
-
A、B、C、D、E 分别是铁、氧气、二氧化碳、硫酸铜溶液和氢氧化钠溶液中的一种物质。两圆相交表示两种物质可以发生化学反应,“→”A物质可以一步反应转化为E。下列说法正确的是
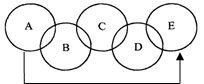
A.A物质一定是氧气
B.C物质一定是硫酸铜溶液
C.C与D反应现象可能是生成蓝色沉淀
D.A转化为E的反应一定是分解反应
难度: 中等查看答案及解析
-
右图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中正确的是

A.a的溶解度随温度的升高而减少
B.a的溶解度大于b的溶解度
C.c的饱和溶液从t2℃降温至t1℃时变为不饱和溶液
D.t1℃时,60 g a的饱和溶液中含有溶剂50 g
难度: 中等查看答案及解析
-
下表列出了除去物质中所含少量杂质的方法,其中不正确的是
选项
物质
所含杂质
除去杂质的方法
A
N2
O2
将气体缓缓通过足量的灼热铜网
B
CaO
CaCO3
加水溶解、过滤
C
Cu
Zn
加入过量的稀盐酸,过滤,洗涤,干燥
D
FeCl2
CuCl2
加入过量的铁粉
难度: 中等查看答案及解析
-
某镁铝合金的样品7.2 g,研成粉末后与200 g稀盐酸恰好完全反应,则稀盐酸的溶质质量分数可能是
A.18.25% B.14.6%
C.12% D.3.6 %
难度: 中等查看答案及解析