-
下列关于能量变化的说法,正确的是( )
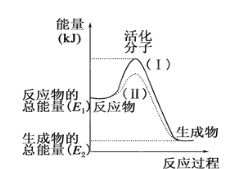
A. 将等质量的红磷和白磷完全燃烧生成P2O3(s)放出热量相同
B. 2Na+ 2H2O= 2NaOH+H2 该反应生成物的总能量高于反应物的总能量
C. 放热反应中,反应物的总能量大于生成物的总能量
D. 有化学键断裂的是吸热过程,并且一定发生了化学变化
难度: 中等查看答案及解析
-
下列关于碱金属元素和卤族元素不正确的是( )
A. 卤族元素从上到下,非金属增强,其对应的单质氧化性逐渐增强。
B. 碱金属元素从上到下,金属性增强,其对应的单质还原性逐渐增强。
C. 卤族元素从上到下,其对应的氢化物稳定性减弱。
D. 碱金属元素和卤族元素分别位于周期表第1和第17纵行
难度: 简单查看答案及解析
-
下列关于化学键的说法正确的是( )
A. 离子化合物中只存在离子键
B. 共价化合物中只存在共价键
C. 物质中都含化学键
D. 只含非金属元素的物质一定不含离子键
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是( )
A. NH4Cl的电子式:
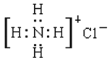 B. S2-的结构示意图:
B. S2-的结构示意图: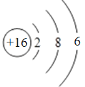
C. 氨的电子式:
D. 碳元素位于第2周期,VIA族
难度: 简单查看答案及解析
-
下列有关元素周期表的说法正确的是( )
A. Li是最活泼金属,F是最活泼非金属
B. 在周期表中金属与非金属的分界处,可找到做催化剂的材料
C. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. 同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
难度: 简单查看答案及解析
-
根据元素周期律判断,下列各组物质的性质比较,正确的是( )
A. 稳定性:NH3>PH3>SiH4 B. 原子半径:S > Na>O
C. 金属性:Li>Na>K D. 酸性: H2SO4>HClO4 > H3PO4
难度: 简单查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则下列说法正确的是( )
A. 原子半径:甲>丙
B. 单质的还原性:丁>丙
C. 乙的氢化物是同族中氢化物还原性最强的
D. 乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
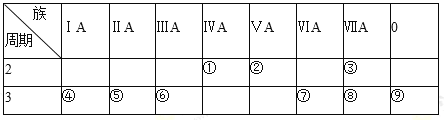
四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
A. 原子半径(r)大小比较r(X)>r(Y)
B. X和W可形成化合物XW3
C. W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D. Z的最低价单核阴离子的失电子能力比Y的强
难度: 简单查看答案及解析
-
下列有关化学反应速率的叙述正确的是( )
A. 通常用反应物或生成物的质量变化来表示化学反应速率
B. 对于任何化学反应来说,反应速率越大,反应现象越明显
C. 在密闭容器中进行的反应C(s)+H2O(g)=CO(g)+H2(g),增加C(s)的量速率不变
D. 某化学反应速率为0.5mol/(L·s)是指该反应在1s时某物质的浓度为0.5mol/L
难度: 简单查看答案及解析
-
下列对化学反应限度的叙述中,不正确的是( )
A. 任何可逆反应都有一定的限度
B. 反应条件改变,化学反应限度可能改变
C. 化学反应达到平衡时,正、逆反应速率一定相等
D. 化学反应达到平衡时,所有物质的微粒均不再变化
难度: 简单查看答案及解析
-
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
难度: 简单查看答案及解析
-
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的 ( )
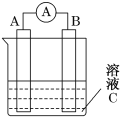
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Cu,B是Fe,C为稀Cu(NO3)2溶液
D. A是Fe,B是Ag,C为稀AgNO3溶液
难度: 简单查看答案及解析
-
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
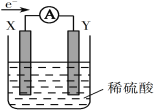
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
难度: 简单查看答案及解析
-
标准状况下,44.8L CH4与一定量Cl2在光照条件下发生取代反应,待反应完全后,测得四种有机取代产物的物质的量相等,则消耗的Cl2为( )
A. 1mol B. 2 mol C. 4mol D. 5 mol
难度: 简单查看答案及解析
-
下列有关烷烃的叙述中,不正确的是( )
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与氯气发生取代反应
C. 烷烃分子的通式为CnH2n+2,符合该通式的烃不一定是烷烃
D. 随着碳原子的增加,烷烃的熔、沸点逐渐升高。
难度: 中等查看答案及解析
-
有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为( )
A. a-n-3 B. a+n+3 C. a+n-3 D. a-n+3
难度: 中等查看答案及解析