-
根据原子结构的相关知识可知,不同种元素的本质区别是( )
A. 质子数不同 B. 中子数不同 C. 电子数不同 D. 质量数不同
难度: 简单查看答案及解析
-
某元素原子核外的电子数为63,下列叙述中错误的是( )
A. 它是副族元素 B. 它是第六周期元素
C. 它的原子核内有63个质子 D. 它属于非金属元素
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 相对分子质量相同的几种化合物,互称为同分异构体
B. 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
C. 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
D. 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
难度: 中等查看答案及解析
-
关于原电池及其电极名称的下列叙述中正确的是( )
A. 原电池的正极和负极必须是两种活动性不同的金属
B. 正极上发生还原反应,一定产生气体
C. 电子流出的一极为负极
D. 阴离子在电解质溶液中向正极移动
难度: 中等查看答案及解析
-
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是( )
A. 金刚石与石墨互为同分异构体
B. 石墨转化为金刚石没有破坏化学键属于物理变化
C. 等质量的石墨与金刚石完全燃烧,放出的能量相同
D. 金刚石不如石墨稳定
难度: 中等查看答案及解析
-
已知反应H2(g) +I2(g)
2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:

下列说法正确的是( )
A. 1mol H2的能量比2 mol H 的能量高
B. 将0.5 mol H2(g) 与1mol I2(g)混合充分反应后放出的热量为0.5a kJ
C. H- I键的键能为0.5(a+b+c) kJ/mol
D. H + I → HI 是吸热变化
难度: 中等查看答案及解析
-
对于元素周期表中第三周期的元素来说,按原子序数递增顺序(稀有气体除外),以下说法正确的是( )
A. 原子半径和离子半径均减小 B. 金属性减弱,非金属性增强
C. 氧化物对应的水化物碱性减弱,酸性增强 D. 单质的熔点降低
难度: 中等查看答案及解析
-
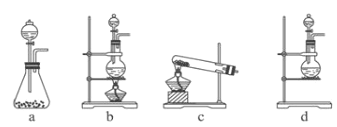
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
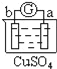
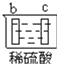
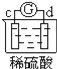
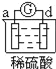
部分实验现象
a极质量减小
b极质量增加
b极有气体产生
c极无变化
d极溶解
c极有气体产生
电流计指示在导线中
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A. d>a>c>b B. b>c>d>a C. d>a>b>c D. a>b>d>c
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①离子化合物中一定有离子键,可能有共价键
②离子化合物都属于强电解质
③非金属单质中不含离子键,一定只含有共价键
④稳定性:HCl>HI,沸点:Br2<I2,酸性:HF>HCl
⑤NaCl 和 HCl 溶于水破坏相同的作用力
⑥共价键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A. ①②⑥ B. ①②④⑥ C. ③④⑤⑥ D. ①④⑤
难度: 中等查看答案及解析
-
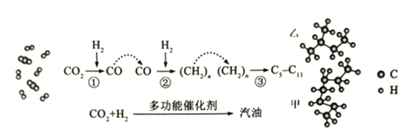
短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如图所示
部分反应物或生成物省略
。下列说法正确的是
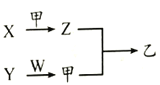
A. 原子半径大小顺序:D>C>B>A
B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应
D. 元素C、D形成的化合物中一定只含离子键
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物(即由两种元素组成的化合物),n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
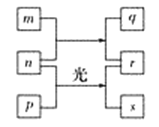
A. n+p→r+s属于置换反应
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
难度: 中等查看答案及解析
-
X、Y、Z均为短周期主族元素,已知它们的原子序数的关系为X+Z=2Y,且Z的最高价氧化物对应的水化物是强酸。则下列有关说法正确的是( )
A. 若X是Na,则Z的最高价一定为偶数
B. 若X是O,则YX一定是离子化合物
C. 若Y是O,则非金属性Z>Y>X
D. 若Y是Na,则X、Z不可能是同一主族元素
难度: 困难查看答案及解析
-
SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是( )

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
难度: 困难查看答案及解析
-
下列描述的化学反应状态,不一定是平衡状态的是( )
A. H2(g)+Br2(g)
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B. 2NO2(g)
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C. CaCO3(s)
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D. N2(g)+3H2(g)
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
②Fe与稀硫酸反应制取H2时,改用98%浓硫酸
③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液
④在K2SO4与BaCl2两溶液反应时,增大压强
⑤2SO2+O2
2SO3,升高温度
⑥Na与水反应时,增大水的用量
A. ①③⑤ B. ②④⑥ C. ①②③⑤ D. ①⑤
难度: 中等查看答案及解析
-
有两种气态烷烃的混合物,在标准状况下其密度为1.16g/L,则关于此混合物组成的说法正确的是( )
A. 一定有甲烷 B. 一定有乙烷
C. 可能是甲烷和戊烷的混合物 D. 可能是乙烷和丙烷的混合物
难度: 中等查看答案及解析
 ]
]