-
“建设天蓝、地绿、水清的美丽中国”是每个中国人的愿望。下列做法与此相符的是
A. 将农作物秸秆就地焚烧,增强土壤肥效
B. 将医疗垃圾深埋处理,减少垃圾对环境的危害
C. 将三聚磷酸钠(Na5P3O10)添加到洗衣粉中,增强去污效果
D. 尽量不开私家车出行,提倡乘坐公共交通工具
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
难度: 中等查看答案及解析
-
由X在酸性条件下制备Y(一种合成香料、医药、农药及染料的中间体)的流程是:
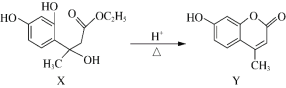
下列说法正确的是
A. X、Y均是芳香烃 B. X、Y互为同分异构体
C. X分子中所有碳原子可能共平面 D. X转化成Y的反应中有消去反应
难度: 中等查看答案及解析
-
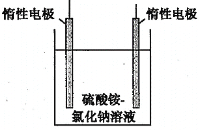
一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是
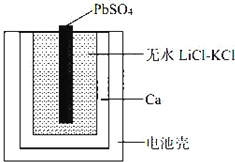
A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
难度: 中等查看答案及解析
-
下列基本操作正确的是
A.
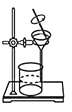 过滤
过滤B.
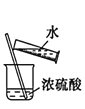 稀释
稀释C.
 尾气处理
尾气处理D.
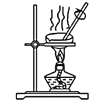 蒸发结晶
蒸发结晶难度: 中等查看答案及解析
-
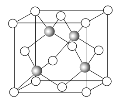
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y是短周期元素中原子半径最大的元素,X、Y、Z的简单离子电子层结构相同,Z与W最外层电子数之和等于10。下列说法不正确的是
A. 简单离子半径由大到小的顺序:W、X、Y、Z
B. X与Y组成化合物的水溶液一定呈碱性
C. Y、Z、W的最高价氧化物的水化物两两之间均能发生反应
D. Z分别与X和W组成的化合物均可用于电解法冶炼Z单质的原料
难度: 中等查看答案及解析
-
25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。
向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示[其中a点的坐标为(9.5,0.5)]。
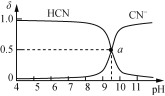

甲 乙
下列溶液中的关系中一定正确的是
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
难度: 困难查看答案及解析