-
下列叙述中正确的是
A. 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B. 除短周期外,其他周期均有18种元素
C. 副族元素中没有非金属元素
D. 碱金属元素是指ⅠA族的所有元素
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3﹣>D﹣>B+>A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
与Na+具有相同的质子数和电子数的粒子是
A. Mg2+ B. Ne C. NH4+ D. OH-
难度: 中等查看答案及解析
-
不能说明氯元素的非金属性比硫元素强的事实是
A. Cl2与H2S溶液发生置换反应
B. HCl是强酸,H2S是弱酸
C. 单质S与Fe反应生成FeS,而Cl2与其反应生成FeCl3
D. HCl比H2S更稳定
难度: 简单查看答案及解析
-
下列各组物质中所含化学键均只有共价键的是
A. NaCl和K2O2 B. HCl和H2O C. HNO3与NH4NO3 D. K2SO4与SO3
难度: 简单查看答案及解析
-
下列叙述不正确的是
A. 含有离子键的化合物一定是离子化合物
B. 含有共价键的化合物一定是共价化合物
C. 12号元素与8号元素能形成AB型离子化合物
D. 镁离子的电子式为:Mg2+
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表,下列叙述正确的是
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
A. X、Y元素的金属性 X<Y
B. Z与W原子之间以离子键形成物质
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,W单质能与 Z单质反应生成有毒物质
难度: 简单查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,Y在短周期元素中原子半径最大,Z的最高正价与最低负价代数之和为4。下列说法不正确的是
A. 氢化物的稳定性:X > W > Z
B. Z与W形成的某种物质能使品红溶液褪色
C. X与Y形成共价化合物
D. W与Y组成的某种物质可以作为呼吸面具的供氧剂
难度: 简单查看答案及解析
-
已知质量数为A的某阳离子Rn+, 核外有X个电子,则核内中子数为:
A. A-X B. A-X- n C. A-X+n D. A+X-n
难度: 中等查看答案及解析
-
下列化学用语或模型正确的是
A. 氯化氢的电子式:
B. N2的结构式:N≡N
C. 硫离子结构示意图:
 D. CH4分子的球棍模型:
D. CH4分子的球棍模型:
难度: 困难查看答案及解析
-
下列有关元素周期表的叙述正确的是()
A. 每一周期的元素都是从金属开始,最后以稀有气体结束
B. 元素周期表中有18个纵行,共有18个族
C. ⅠB~ⅧB族是副族元素,完全由长周期元素构成
D. 第2、3周期同主族上下相邻元素的原子核外电子数相差8个
难度: 简单查看答案及解析
-
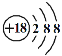
2019年是“国际化学元素周期表年”。下列有关“At”“Ga”“Ce”“F”等元素的说法错误的是
A. 砹(At)属于过渡元素
B. 门捷列夫预言的“类铝”—镓(Ga)元素的发现,证实了元素周期律的科学性
C.
原子核内的中子数为82
D. 第ⅡA族的元素全部是金属元素
难度: 中等查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由图表示。在下列因素中对产生H2速率有影响的是
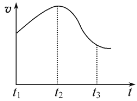
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
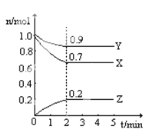
对于反应A(g)+3B(s)===2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=0.5 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(D)=0.4 mol·L-1·min-1 D. v(C)=0.1 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列离子组能在溶液中大量共存的是
A. Fe2+、H +、Na+、NO3- B. SiO32-、K+、Br-、H +
C. NH4+、Cl-、Mg2+、SO42- D. Na +、OH-、NH4+、I-
难度: 简单查看答案及解析
-
下列关于浓硫酸的叙述正确的是
A. 浓硫酸在常温下能够使铁、铝等金属钝化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸具有吸水性,因而能使蔗糖碳化
难度: 简单查看答案及解析
-
下列四种溶液中,一定存在SO42-的是
A. 向甲溶液中加入BaCl2溶液,有白色沉淀产生
B. 向乙溶液中加入BaCl2溶液,有白色沉淀产生,再加入盐酸沉淀不溶解
C. 向丙溶液中加入盐酸使之酸化,无白色沉淀,再加入BaCl2溶液,有白色沉淀产生
D. 向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生
难度: 中等查看答案及解析
-
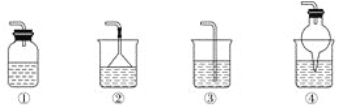
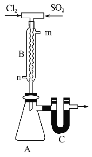
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是
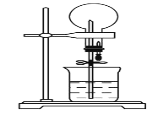
A. SO2(NaOH溶液)无色喷泉
B. NH3(H2O含酚酞)红色喷泉
C. NO(H2O含石蕊)红色喷泉
D. HCl(AgNO3溶液)白色喷泉
难度: 简单查看答案及解析
-
用一种试剂可鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是
A. Ba(OH)2 B. KSCN C. NaOH D. BaCl2
难度: 中等查看答案及解析
-
盛有NO 和NO2 的混合气体25 mL的量筒倒立在水槽中,过一段时间后,气体体积减小为15 mL 。则原混合气体中NO 和NO2的体积比是
A. 3∶2 B. 2∶3 C. 2∶1 D. 4∶1
难度: 中等查看答案及解析
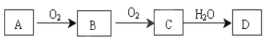
 ③O2 ④
③O2 ④ ⑤O3 ⑥16O ⑦CO ⑧ 18O
⑤O3 ⑥16O ⑦CO ⑧ 18O