-
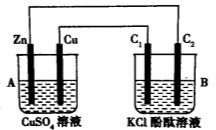
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是
A. A>B>C>D>E B. A>C>D>B>E
C. C>A>B>D>E D. B>D>C>A>E
难度: 中等查看答案及解析
-
下列有关原电池的叙述正确的是( )
A. 原电池能将化学能转变为电能
B. 原电池的负极发生还原反应
C. 原电池在工作时,正极不断产生电子并经外电路流向负极
D. 原电池工作时,阳离子向负极移动
难度: 中等查看答案及解析
-
下列电离方程式中正确的( )
A. NaHSO4⇌Na++H++SO42-
B. NaHCO3═Na++H++CO32-
C. HClO ═ H++ClO-
D. H2S ⇌H++HS- , HS- ⇌H++S2-
难度: 中等查看答案及解析
-
将PH=2和PH=5的稀硫酸等体积混合,混合后溶液的PH约为( )
A. 3.5 B. 3 C. 7 D. 2.3
难度: 中等查看答案及解析
-
当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是
A.NH4Cl B.NaOH C.Na2CO3 D.Fe
难度: 中等查看答案及解析
-
用0.01mol/LNaOH溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
A. 硫酸 B. 盐酸 C. 醋酸 D. 高氯酸
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A. Na2CO3NaHCO3NaCl NH4Cl
B. Na2CO3NaHCO3NH4Cl NaCl
C. (NH4)2SO4NH4Cl NaNO3Na2S
D. NH4Cl (NH4)2SO4Na2S NaNO3
难度: 中等查看答案及解析
-
下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
难度: 简单查看答案及解析
-
己知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,Ksp(Ag2CrO4)=2.0×10-12,某溶液中含有Cl-、Br-和CrO42-,浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的 AgNO3溶液时,三种阴离子产生沉淀的先后顺序是 ( )
A. Cl- > Br->CrO42-
B. Br- >CrO42-> Cl-
C. CrO42-> Br- >Cl-
D. Br->Cl->CrO42-
难度: 困难查看答案及解析
-
工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法不正确的是( )
A. 该反应达平衡时c(Mn2+)=c(Cu2+)
B. 该反应的平衡常数K= Ksp(MnS)/ Ksp(CuS)
C. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D. MnS的Ksp比CuS的Ksp大
难度: 困难查看答案及解析
-
用石墨做电极电解CuSO4溶液.通电一段时间后,溶液中仍有Cu2+,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
A. CuSO4 B. CuO C. H2O D. Cu(OH)2
难度: 中等查看答案及解析
-
某原电池电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法中可能正确的是( )
A. 硝酸为电解质溶液 B. 锌为原电池正极
C. 铁电极质量不变 D. 铜为原电池正极
难度: 中等查看答案及解析
-
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )
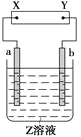
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
A. A B. B C. C D. D
难度: 简单查看答案及解析