-
俄罗斯科学家用
和
两种核素在地球和月球的含量比例精确确定了地球和月球的年龄。下列有关
和
的说法正确的是
A.
和
的中子数相等 B.
和
的原子质量几乎相等
C.
和
互为同位素 D. Hf和W在元素周期表中处于相邻位置
难度: 中等查看答案及解析
-
下列物质只含有离子键的是
A. CO2 B. CaCl2 C. NH4Cl D. NaOH
难度: 中等查看答案及解析
-
化学反应达到化学平衡的标志是
A. 逆反应停止进行 B. 反应物与生成物的浓度相等
C. 正反应与逆反应停止进行 D. 正反应速率和逆反应速率相等
难度: 中等查看答案及解析
-
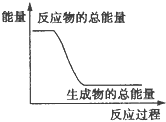
对于化学反应中的能量变化,表述准确的是
A. 形成新化学键的过程会放出能量 B. 中和反应是吸热反应
C. 加热才能发生的反应是吸热反应 D. 生成CO2的反应是放热反应
难度: 中等查看答案及解析
-
下列推测或结论不合理的是( )
A. X2-和Y+核外电子层结构相同,原子序数:X<Y
B. 气态氢化物的稳定性HCl>HBr,还原性:Cl->Br-
C. 硅、锗都位于金属与非金属元素的交界处,都可以作半导体材料
D. 铷(37Rb)和锶(38Sr)分别位于第五周期ⅠA族和ⅡA族,碱性:RbOH>Sr(OH)2
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律表述正确的是
①稀有气体不活泼是因为它们原子最外层都已达到8电子稳定结构
②第ⅦA族元素是同周期中非金属性最强的元素
③第二周期第ⅣA族元素的核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A. H、D、T互为同素异形体 B. 氨分子中的化学键为非极性共价键
C. NH4Cl的电子式:
D. S2-的结构示意图:

难度: 中等查看答案及解析
-
下列关于元素周期表的说法中正确的是
A. 元素周期表有8个主族
B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期
D. 短周期是指第1、2周期
难度: 中等查看答案及解析
-
下列实验过程中,一定同时存在化学键的断裂和形成的是
A. 分离碳酸钙与氯化钠的混合物
B. 观察碳酸钠的焰色反应
C. 分离二氧化硅与氯化铵的化合物

D. 用苯萃取碘水中的碘
难度: 中等查看答案及解析
-
现有部分短周期元素的性质或原子结构,如下表:
元素代号
元素性质或原子结构
T
M层上的电子数为6个
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是 +7
下列叙述中,不正确的是
A. 14X可用于测定文物的年代 B. Z的非金属性比T强
C. Y和T位于同一主族 D. X元素形成的化合物种类有很多
难度: 中等查看答案及解析
-
如下性质的递变中,不正确的是
A. HCl、H2S、PH3的稳定性依次减弱
B. HClO4、H2SO4、H3PO4、H4SiO4的酸性依次减弱(相同条件下)
C. CsOH、KOH、LiOH的碱性依次减弱
D. Na+、Mg2+、Al3+ 的氧化性依次减弱
难度: 中等查看答案及解析
-
X、Y、Z、W、R是五种短周期元素,原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一主族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A. 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B. 元素X不能与元素Y形成化合物X2Y2
C. 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D. 元素W、R的最高价氧化物对应的水化物都强酸
难度: 中等查看答案及解析
-
下列说法中,错误的是
A. 化学反应中,有放热反应也有吸热反应
B. 煤、石油、天然气是当今世界最重要的三种化石燃料
C. Ba(OH)2·8H2O与NH4Cl晶体的反应是吸热反应
D. 化学反应中能量变化的大小与反应物的质量多少无关
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法错误的是
A. 化学反应速率用于衡量化学反应进行的快慢
B. 可逆反应达到化学平衡状态时,正、逆反应速率都为0
C. 决定化学反应速率的主要因素是反应物质性质
D. 增大反应物浓度、提高反应体系的温度都能增大化学反应速率
难度: 中等查看答案及解析
-
已知:2H2(g) + O2(g) ===2H2O(g),1mol H2完全反应放出热量241.8 kJ,有关键能数据如下表:
化学键
H-O
O=O
键能/ (kJ·mol-1)
463.4
498
则H-H的键能为(拆开1mol化学键所需吸收的能量叫做键能)
A. 413 kJ·mol-1 B. 557 kJ·mol-1
C. 221.6 kJ·mol-1 D. 436 kJ·mol-1
难度: 中等查看答案及解析
-
在2L的密闭容器中进行反应:3H2(g) + N2(g)
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 s B. 20 s C. 30 s D. 40 s
难度: 中等查看答案及解析
-
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。下列结论正确的是
测定时刻/s
t1
t2
t3
t4
c(A) / (mol·L-1)
6
3
2
2
c(B) / (mol·L-1)
5
3.5
3
3
c(C) / (mol·L-1)
1
2.5
3
3
A. 在t3时刻反应已经停止
B. t3~t4内正、逆反应速率不相等
C. 在容器中发生的反应为A + B
C
D. 在t2~t3内A的平均反应速率为
mol·L-1·s-1
难度: 中等查看答案及解析
-
华中科技大学一项科学研究表明:一种被称为Li-空气微型石墨烯超级电容器的电池,它充电和放电的速率是标准电池的100至1000倍。该电池由单原子层的碳构成,放电时将锂氧化产生锂离子和电子,空气中的氧分子得到电子进行还原反应,从而产生电能。则下列说法正确的是
A. Li电极是该电池的正极
B. O2在电极上发生氧化反应,其电极反应式为:O2 + 2H2O + 4e-=4OH-
C. 12g单层石墨中含有六元环的个数为0.5NA(结构示意图如图,NA表示阿伏加德罗常数的值)
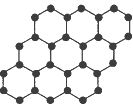
D. 放电时,电池中有OH-向负极移动
难度: 中等查看答案及解析
-
下面是几种常见的化学电源示意图,有关说法不正确的是
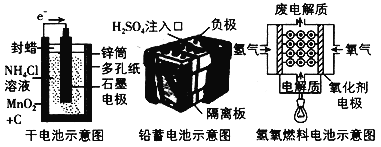
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅蓄电池工作过程中,每转移2 mol电子,负极质量减小207g
D. 氢氧燃料电池是一种具有广阔应用前景的绿色电源
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
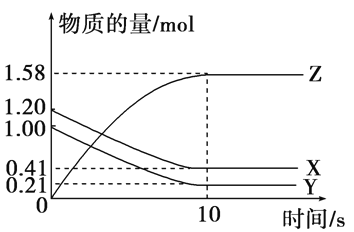
下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C. 反应开始到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析