-
2019年3月21日,江苏响水化工厂发生特大爆炸事故. 当地环保部门在现场检测到爆炸产生的气体有SO2、氮氧化物、挥发性有机物等. 下列说法不正确的是
A. 燃煤中加入CaO可以减少SO2气体的排放
B. 光化学烟雾的形成与氮氧化物有关
C. SO2随雨水降下可能形成酸雨
D. 空气质量报告中有可吸入颗粒、SO2、 NO2、 CO2
难度: 简单查看答案及解析
-
下列化学用语中,正确的是
A. 次氯酸的结构式:H—O—Cl
B. 氚的原子符号:21H
C. 用电子式表示氯化氢分子的形成过程:
D. Mg2+的结构示意图:
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol−1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1,则C的燃烧热为△H =- 110.5 kJ·mol−1
C. 25℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= -38.6kJ·mol−1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol−1
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值.下列叙述正确的是
A. 标准状况下,22.4 L H2O中含有的分子数为NA
B. 32gO2中含有的电子数为32NA
C. 32gO2和O3的混合物中含有的氧原子数目为2NA
D. 1 molNa2O2与足量的CO2反应转移的电子数为2NA
难度: 中等查看答案及解析
-
14C是C的一种放射性核素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C.下列说法正确的是
A. 14C原子最外层有6个电子 B. 14C核素的中子数为8
C. 14C和14N互为同位素 D. 14C16O2的质子数为46
难度: 中等查看答案及解析
-
纯二氧化硅可用下列流程制得。下列说法不正确的是
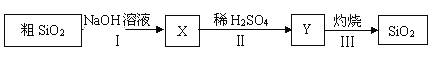
A. X可用作木材防火剂
B. 步骤Ⅱ中的稀硫酸可用CO2来代替
C. 步骤II的反应是Na2SiO3+ H2SO4 = H2SiO3(胶体) + Na2SO4
D. 步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行
难度: 中等查看答案及解析
-
5种短周期元素A、B、C、D、E的原子序数依次增大,依据表中信息判断,下列说法不正确的是
元素
A
B
C
D
E
相关
信息
A的一种核素在考古时常用来鉴定一些文物的年代
有两种常见的单质,均有氧化性
短周期中原子半径最大的元素
最外层电子数与电子层相同
其游离态单质存在于火山喷口附近和地壳的岩层里
A. A的单质有多种同素异形体,其中一种是自然界中最坚硬的物质
B. C的单质燃烧火焰呈黄色
C. D的最高价氧化物可分别溶于A、C、E的最高价氧化物对应的水化物的溶液
D. B和E的最简单气态氢化物中稳定性较差的是E
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 铁钉放入硫酸铜溶液中:2Fe+3Cu2+=2Fe3++3Cu
B. 金属铜溶于稀硝酸中: Cu+2NO3—+4H +=Cu2++2NO↑+2H2O
C. 碳酸氢铵溶液中加入足量的氢氧化钠中:NH4++OH-=NH3 + H2O
D. 少量二氧化硫通入澄清石灰水中:SO2+Ca2++2OH-=CaSO3↓+H2O
难度: 中等查看答案及解析
-
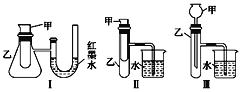
以下实验目的可以实现的是
A. 产生喷泉
 B.
B. 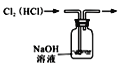 除去氯气中的HCl杂质
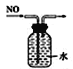
除去氯气中的HCl杂质C. 排水法收集NO
 D.
D. 蒸发溴水获取溴单质
难度: 中等查看答案及解析
-
下列叙述中,不正确的是
A. 浓HNO3与浓HCl按体积比1:3所得的混合物叫王水
B. 工业上用H2和N2合成氨与自然界中放电时N2和O2反应都属于氮的固定
C. 常温下,铁或铝不与浓H2SO4反应,所以可用铁或铝制的容器贮存浓H2SO4
D. 浓H2SO4具有吸水性,能使胆矾变白
难度: 中等查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素性质,下列说法正确的是
A. 因为酸性HF<HCl<HBr<HI, 所以非金属性F<Cl<Br<I
B. 因为Cl2可以从NaBr溶液中置换出Br2,所以非金属性Cl>Br
C. 金属Na与O2在加热时有Na2O2生成,可以推断Li与O2在加热时有Li2O2生成
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
如图所示为反应2H2(g)+ O2(g) = 2H2O(g)的能量变化示意图,下列说法错误的是( )
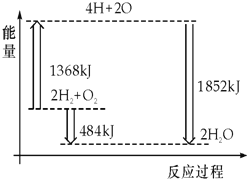
A. 拆开2mol H2(g)和1mol O2(g) 中的化学键共吸收1368kJ能量
B. 由H、O原子形成2mol H2O(g),共放出1852kJ能量
C. 1mol H2(g)和
mol O2(g)反应生成1mol H2O(l),放出的热量小于242kJ
D. 2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ热量
难度: 中等查看答案及解析