-
酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:
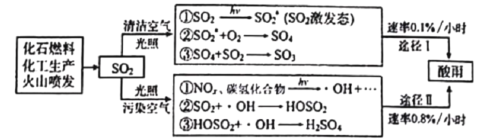
下列有关说法错误的是( )
A. 光照能引发酸雨的形成
B. 所涉及的变化均为氧化还原反应
C. 污染空气能加快酸雨的形成
D. 优化能源结构能有效遏制酸雨污染
难度: 简单查看答案及解析
-
某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法正确的是
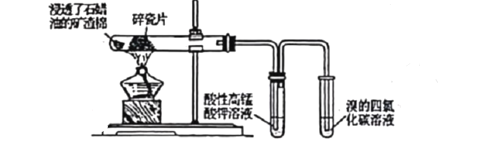
A. 石蜡油是含多种液态烷烃的混合物
B. 硬质试管中的碎瓷片起防爆沸的作用
C. 酸性高锰酸钾溶液褪色说明生成了乙烯
D. 溴的四氯化碳溶液褪色是因为发生了取代反应
难度: 中等查看答案及解析
-
若NA表示阿伏伽德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24L N2和O2的混合气体中分子数为0.1NA
B. 32g S8(分子结构:
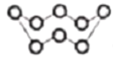 )中的共价键数目为8NA
)中的共价键数目为8NAC. 3mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. pH=1的H3BO3溶液中,含有H+的总数为0.3NA
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列说法正确的是
A. 原子半径:M>Z>Y>X B. 4种元素中Y的非金属性最强
C. Z的氧化物的水化物是强酸 D. 元素X可与元素M形成共价化合物XM2
难度: 中等查看答案及解析
-
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法正确的是
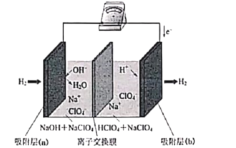
A. 吸附层(a)上的电势比吸附层(b)上的高
B. 负极反应为H2+2e-+2OH-=2H2O
C. 该装置将酸碱中和反应的热能转化为电能
D. 电解质溶液中ClO4-由左往右迁移
难度: 中等查看答案及解析
-
根据下列实验操作和现象得出的结论正确的是
选项
实验操作
现象
结论
A
取一块用砂纸打磨过的铝箔在酒精灯上加热
铝箔变软且失去光泽,但不滴落
打磨过程不充分,未能完全损坏氧化膜
B
向溴水中加入少量CCl4,振荡后静置
上层接近无色,下层显橙红色
Br2在CCl4中的溶解度大于在水中的溶解度
C
向某溶液中滴加盐酸,将生成的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有CO32-
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液
有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是
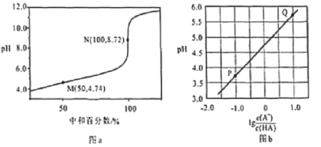
A. 当滴定至溶液呈中性时,c(A-)>c(HA) B. N点,c(Na+)·c(A-)=
C. Ka(HA)的数量级为10-5 D. P-Q过程中,水的电离程度逐渐增大
难度: 中等查看答案及解析

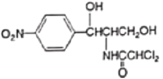 )曾用作广谱抗菌药物,一种合成路线如下:
)曾用作广谱抗菌药物,一种合成路线如下:
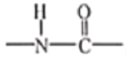 的性质与酯基相似。
的性质与酯基相似。