-
化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是
A. 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B. “春蚕到死丝方尽,烛炬成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
C. 施肥时,铵态氮肥不能与草木灰混合使用
D. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
难度: 中等查看答案及解析
-
下列与阿伏加德罗常数的值(NA)有关的说法正确的是
A. 标准状况下,44.8LHF中含有氢原子的数目为2NA
B. 8.0gCu2S和 CuO的混合物中含有铜原子数为0.1NA
C. 0.2mol·L-1的碳酸钠溶液中CO32-的数目小于0.2NA
D. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
难度: 中等查看答案及解析
-
“碳呼吸电池”是一种新型化学电源,其工作原理如图。下列说法正确的是
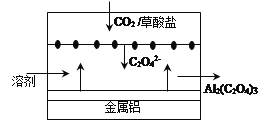
A. 该装置能将电能转变为化学能
B. 正极的电极反应为:C2O42--2e-=2CO2
C. 每得到1 mol草酸铝,电路中转移3 mol电子
D. 利用该技术可捕捉大气中的CO2
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 离子化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 工业上常用电解Z与W形成的化合物的方法制取单质Z
难度: 中等查看答案及解析
-
按如图装置进行实验,下列推断正确的是( )
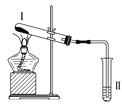
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
铁粉与水蒸气发生了反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是
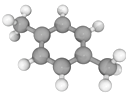
A. “PX”的二氯代物共有6种(不考虑立体异构) B. “PX”的分子式为C8H10
C. “PX”分子中,最多有14个原子共面 D. 可用酸性KMnO4溶液鉴别“PX”与苯
难度: 中等查看答案及解析
-
常温下,改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数
(X)随pH的变化如图所示[已知
(X) =
]。下列叙述错误的是( )
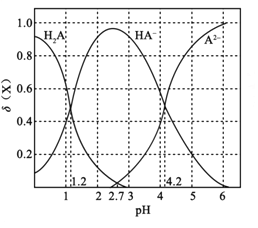
A. pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH-)
B. 常温下,H2A的电离平衡常数Ka2=10-42
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D. KHA溶液中离子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
难度: 困难查看答案及解析
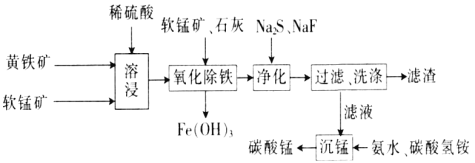
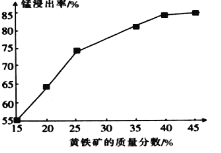
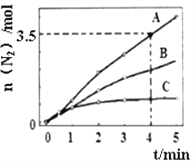
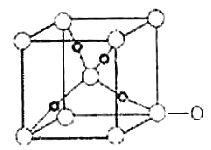
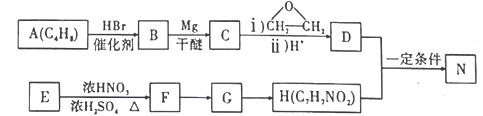
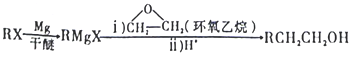
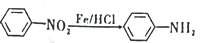 (苯胺,易被氧化)。
(苯胺,易被氧化)。