-
某元素的原子3d能级上有1个电子,它的N能层上电子数是( )
A. 0 B. 2 C. 5 D. 8
难度: 中等查看答案及解析
-
下列晶体熔化时不需破坏化学键的是( )
A. 晶体硅 B. 食盐晶体 C. 固体碘 D. 金属钾
难度: 简单查看答案及解析
-
下列晶体中,不属于原子晶体的是()
A. 金刚石 B. 水晶 C. 金刚砂 D. 干冰
难度: 简单查看答案及解析
-
符号“3px”没有给出的信息是( )
A. 电子层 B. 电子亚层 C. 电子云在空间的伸展方向 D. 电子的自旋方向
难度: 简单查看答案及解析
-
下列各组元素中,电负性依次减小的是()
A. K、Na、Al B. O、Cl、H C. As、P、H D. O、S、Cl
难度: 中等查看答案及解析
-
下列原子中,第一电离能最大的是()
A. B B. C C. Al D. Si
难度: 中等查看答案及解析
-
下列能跟氢原子形成最强极性键的原子是()
A. F B. Cl C. Br D. I
难度: 简单查看答案及解析
-
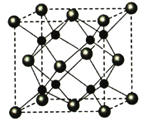
金属晶体的堆积方式、空间利用率和配位数关系正确的是( )
A. 钋Po——简单立方堆积——52%——6
B. 钠Na——钾型——74%——12
C. 锌Zn——镁型——68%——8
D. 银Ag——铜型——74%——8
难度: 中等查看答案及解析
-
下列物质的分子中,只由σ键形成的是()
A. 氮气 B. 甲烷 C. 乙烯 D. 乙炔
难度: 简单查看答案及解析
-
下列物质固态时熔点的比较正确的是( )
A. F2>Cl2>Br2 B. 金刚石>P4>O2 C. S>HBr>金刚石 D. I2>CH4>冰
难度: 中等查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是()
A.
B.
C.
D.
难度: 简单查看答案及解析
-
一个电子排布为1s22s22p63s23p1的元素最可能的价态是()
A. +1 B. +2 C. +3 D. -1
难度: 中等查看答案及解析
-
根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说明中正确的是()
A. 溴、碘单质和四氯化碳中都含有卤素
B. 溴、碘是单质,四氯化碳是化合物
C. Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D. 以上说法都不对
难度: 中等查看答案及解析
-
下列各组粒子不能互称为等电子体的是()
A. CO和N2 B. O3和SO2 C. CO2和N2O D. N2H4和 C2H4
难度: 中等查看答案及解析
-
H+离子与NH3分子反应生成NH4+离子,它们之间的相互作用是
A. 离子键 B. 分子间的作用 C. 配位键 D. 非极性共价键
难度: 简单查看答案及解析
-
下列说法正确的是()
A. 1molNa2O2晶体中阴离子与阳离子之比为1:1
B. 1molSi晶体中含4molSi—Si键
C. 60gSiO2中含Si—O键的个数为4NA
D. 12 g金刚石中含有C—C键的个数为NA
难度: 中等查看答案及解析
-
HBr分子的电子式为( )
A.
B.
C.
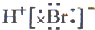 D.
D. 难度: 中等查看答案及解析
-
下列化合物中,与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物相符的是()
A. MgBr2 B. Na2O C. KCl D. KF
难度: 简单查看答案及解析
-
下列关于氢键的说法中,正确的是()
A. 氢键比分子间作用力强,所以它属于化学键
B. 分子内形成的氢键使物质的熔点和沸点升高
C. 氨溶于水后氨分子和水分子之间形成了氢键
D. 邻羟基苯甲醛的熔点比对羟基苯甲醛的熔点高
难度: 中等查看答案及解析
-
根据价层电子对互斥理论及原子轨道的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()
A. 直线形sp杂化 B. 三角形 sp2杂化
C. 三角锥形 sp2杂化 D. 三角锥形 sp3杂化
难度: 中等查看答案及解析
-
关于
分子,下列说法正确的是()
A. 羰基碳原子和甲基碳原子成键时所采取的杂化方式均为sp2杂化
B. 羰基碳原子和甲基碳原子成键时所采取的杂化方式均为sp3杂化
C. 羰基碳原子和甲基碳原子成键时所采取的杂化方式分别为sp2杂化和sp3杂化
D. 该分子中所有的原子都在同一个平面上
难度: 中等查看答案及解析
-
根据等电子原理,下列各组分子或离子的空间构型不相似的是()
A. NH4+和CH4 B. H3O+和NH3 C. NO3-和CO32- D. CO2和H2O
难度: 中等查看答案及解析
-
下列配合物的配位数不是6的是()
A. [Co (NH3)3(H2O)3](NO3)3
B. [Cu(NH3)4]Cl2
C. Na3[AlF6]
D. Na2[SiF6]
难度: 中等查看答案及解析