-
下列各式中属于正确的水解反应离子方程式的是( )
A. HS-+H2O⇌S2-+H3O+ B. S2-+2H2O⇌H2S+2OH-
C. NH4++H2O⇌NH3•H2O+H+ D. CH3 COO-+H+⇌CH3COOH
难度: 中等查看答案及解析
-
室温下,下列事实不能说明NH3•H2O为弱电解质的是( )
A. 0.1mol⋅L-1 NH3⋅H2O.溶液的pH小于13
B. 0.1mol⋅L-1 NH4Cl溶液的pH小于7
C. 相同条件下,pH相同的NaOH溶液和氨水,加水稀释相同倍数后,氨水的碱性较强
D. 向0.1mol⋅L-1 NH3⋅H2O溶液中加入MgCl2溶液产生白色沉淀
难度: 中等查看答案及解析
-
下列各项与盐类水解有关的是( )
①为配制FeCl3溶液,要现将其溶解于浓盐酸中,再加水稀释;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
A. 只有①④ B. 只有②③ C. 只有③④
D. 全部
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. AlCl3溶液和Al2(SO4)3溶液蒸干都得不到原溶质
B. pH为3的盐酸中的c(H+)是pH为1的盐酸的100倍
C. Na2 CO3溶液与NaHCO3溶液中所含微粒的种类一定相同
D. pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
难度: 中等查看答案及解析
-
已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为CuSO4·5H2O(s)=CuSO4(s)+5H2O(l)ΔH=+Q1kJ·mol-1,室温下,无水硫酸铜溶于水的热化学方程式为CuSO4(s)=Cu2+(aq)+SO42- (aq) ΔH=-Q2 kJ/mol,则( )
A. Q1>Q2 B. Q1=Q2
C. Q1<Q2 D. 无法比较
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. 某吸热反应能自发进行,因此该反应是熵增反应
B. 2NO(g)+2CO(g)=N2 (g)+2CO2 (g)在常温下能自发进行,则该反应的ΔH>0
C. CaCO3 (s)=CaO(s)+CO2 (g)室温下不能自发进行,说明该反应的ΔH<0
D. 对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
难度: 简单查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应:C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
A. 加入NaOH溶液,可增大乙醇的物质的量
B. 增大氢溴酸的浓度,有利于生成C2H5Br
C. 若反应物均增大至2 mol,则两种反应物平衡转化率之比变大
D. 若起始温度提高至60℃,有利于提高C2H5Br的产量
难度: 中等查看答案及解析
-
下列物质的溶液中所含离子种类最多的是( )
A. Na2S B. Na3PO4 C. NaHCO3 D. H2SO4
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol • L−1的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液。下列说法错误的是( )
A. 溶液的pH:②>③>①
B. 水电离出的c(OH-):③>①>②
C. ②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D. ①和②等体积混合后的溶液c(CH3COOH)+c(CH3COO-)=0.1mol⋅L-1
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
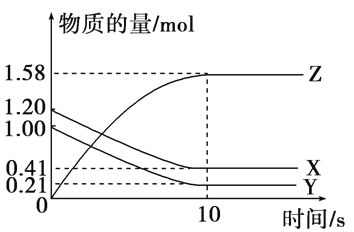
下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C. 反应开始到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
A.
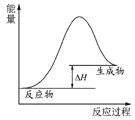 表示燃料燃烧反应的能量变化
表示燃料燃烧反应的能量变化B.
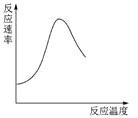 表示酶催化反应的反应速率随反应温度的变化
表示酶催化反应的反应速率随反应温度的变化C.
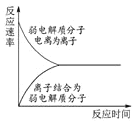 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程D.
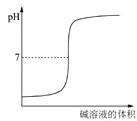 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)⇌bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
A. 平衡向正反应方向移动了 B. 物质A的转化率增大了
C. 物质B的质量分数增加了 D. a>b
难度: 中等查看答案及解析