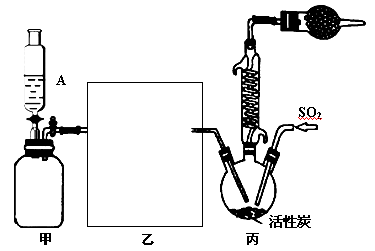
-
化学与生产、生活息息相关,下列叙述错误的是( )
A. 铁表面镀锌可增强其抗腐蚀性
B. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 含重金属离子的电镀废液不能随意排放
难度: 简单查看答案及解析
-
下列反应中氯元素全部被还原的是
A. 5Cl2+I2+6H2O=10HCl+2HIO3
B. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C. MnO2+4HCl=MnCl2+2H2O+Cl2↑
D. 2NaCl+2H2O=2NaOH+Cl2↑+H2↑
难度: 中等查看答案及解析
-
下列排列顺序正确的是
A. 常温下将0.1 mol·L-1NH4Cl溶液与0.05 mol·L-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+)
B. 常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
C. 0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D. 在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
难度: 简单查看答案及解析
-
能将(NH4)2SO4、K2SO4、NH4Cl、KCl四种溶液鉴别开的试剂是
A.NaOH溶液 B.Ba(OH)2溶液 C.BaCl2溶液 D.AgNO3溶液
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.由H原子形成1 mol H—H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.空气质量指数(AQI )中参与空气质量评价的主要污染物为细颗粒物( PM2.5 )、可吸入颗粒物(PM10)、二氧化硫、二氧化氮、臭氧、一氧化碳等六项
B.福尔马林具有杀菌防腐性质,故可用作食品添加剂
C.糖类、油脂、蛋白质、维生素、水和无机盐是人体所需的六大营养物质
D.金属钠着火时不能使用泡沫灭火器灭火
难度: 简单查看答案及解析
-
常温下,下列物质的水溶液,其pH值大于7的是
A. KNO3 B. NaHSO4 C. NH4Br D. NaF
难度: 简单查看答案及解析
-
将9.2 g金属钠投入到100 g下列不同质量分数的盐酸中,则放出的氢气( )
①2.00% ②3.65% ③10% ④36.5%
A. ①最少 B. ④最多 C. ③居中 D. 一样多
难度: 中等查看答案及解析
-
某有机化合物A的相对分子质量范围为100~130。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al
2Fe+Al2O3,关于该反应的叙述错误的是
A. 属于置换反应 B. Al作还原剂 C. Fe2O3被还原 D. 该反应是吸热反应
难度: 简单查看答案及解析
-
下列图象与对应实验完全吻合的是:

A.①往一定量的盐酸中滴加NaOH溶液至过量
B.②将一定量的不饱和KNO3溶液恒温蒸发水
C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2)
难度: 简单查看答案及解析
-
下列物质中属于非电解质的是
A.Cl2 B.HCl C.NH3 D.NaOH
难度: 简单查看答案及解析
-
下列关于金属及其化合物的性质或用途说法正确的是( )
A.铝合金是用途最广的合金,工业上通过电解熔融AlCl3制金属铝
B.节日燃放的烟花是利用了碱金属单质焰色反应所呈现的色彩
C.Fe2O3俗称磁性氧化铁,常用作红色油漆和涂料
D.铜盐溶液都有毒,主要是铜离子会使蛋白质变性
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式的是 ( )
A. 实验室用大理石和稀盐酸制取CO2 :2H++CO32- = CO2↑+H2O
B. 硫酸铜与氢氧化钡溶液反应:Ba2++SO42- = BaSO4 ↓
C. Fe(OH)3与盐酸反应:H++ OH- = H2O
D. Fe2O3溶于稀硫酸: 6H++ Fe2O3 = 2 Fe 3++3H2O
难度: 中等查看答案及解析
-
周期表中有些元素有“隔类相似”现象(即对角线相似),如Mg与Li;Si和B;Be和Al等,现用熔融LiCl电解可得锂和氯气,若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电
极电解。结果得到金属锂和一种无色无味气体,其主要理由是( )
A. 电解出的锂和水反应放出氢气
B. 电解前LiCl在加热时水解
C. 电解时产生的无色气体是氯气
D. 在高温时阳极放出氯气与水作用释氧
难度: 中等查看答案及解析
-
下列各指定粒子数目不等于阿伏加德罗常数的是
A.1g H2所含的原子个数
B.4g氦气所含的原子个数
C.23g金属Na全部转变为金属离子时失去的电子个数
D.16g O2所含的分子个数
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX2+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数c>d
B. 氢化物的稳定性H2Y>HZ
C. 离子半径X2+<W3+
D. 第一电离能X>W
难度: 中等查看答案及解析
-
下列化学变化中,需加入氧化剂才能实现的是( )
A. C→CO2 B. CO2→CO C. CuO→Cu D. H2SO4→BaSO4
难度: 中等查看答案及解析
-
向明矾溶液里滴入Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是
A. 一部分Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B. 一部分为Al(OH)3沉淀,一部分以AlO2-形式存于溶液中
C. 全部为Al(OH)3沉淀
D. 几乎全部以AlO2-形式存在于溶液中
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数数值,下列叙述中正确的是( )
A.1.8 g的NH4+ 离子中含有的电子数为0.1NA
B.1mol Na2O2 固体中含离子总数为4NA
C.标准状况下,2.24L CCl4所含的共价键数为O.4NA
D.常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA
难度: 中等查看答案及解析
-
下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A. 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>①
B. pH=2 的H2C2O4溶液与pH=12 的NaOH 溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C. 向0.2mo/L 的NaHCO3 溶液中加入等体积0.1mo/L 的NaOH 溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,等浓度的CH3COOH与CH3COONa 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(H+)+c(Na+)
难度: 困难查看答案及解析
-
1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
难度: 中等查看答案及解析
-
下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
选项
条件
离子组
离子共存判断及离子方程式
A
滴加氨水
Na+、Al3+、Cl-、NO3-
不能共存Al3++3OH-=Al(OH)3
B
pH=1的溶液
Fe2+、Al3+、SO42-、MnO4-
不能共存5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
C
由水电离出的c(H+)=10-12mol/L
NH4+、Na+、NO3-、Cl-
一定能共存NH4++H2O =NH3.H2O+H+
D
通入少量SO2 气体
K+、Na+、ClO-、SO42-
不能共存,2ClO-+SO2+H2O=2HClO+SO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
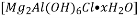 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为
 热分解的化学方程式为______________________。
热分解的化学方程式为______________________。