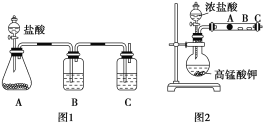
-
下列关于
Pt与
Pt的说法正确的是( )
A.
Pt与
Pt是同一种核素 B.
Pt与
Pt的质量数相同
C.
Pt与
Pt互为同位素 D.
Pt与
Pt的中子数均为78
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关,下列说法不正确的是( )
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”是葛洪提取青蒿素的过程,属化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
难度: 简单查看答案及解析
-
下列变化中,不属于化学变化的是( )
A. SO2使品红溶液褪色 B. 活性炭使红墨水褪色
C. 氯水使有色布条褪色 D. 漂粉精使某些染料褪色
难度: 简单查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
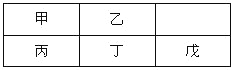
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 二氧化硅材料广泛用于光纤通信
B. 浓硫酸是一种干燥剂,能够干燥O2、NH3、H2S等气体
C. NaOH 溶液应保存在带有磨口玻璃塞的试剂瓶中
D. 硝酸能与Zn、Fe等金属反应成H2
难度: 中等查看答案及解析
-
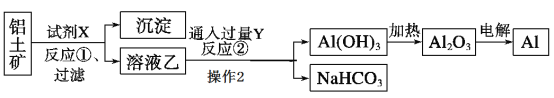
既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
①Al ②Al2O3 ③NaHCO3 ④Al(OH)3
A. ③④ B. ②③④ C. ①③④ D. 全部
难度: 中等查看答案及解析
-
卤族元素按F、Cl、Br、I的顺序,下列叙述正确的是( )
A. 单质的颜色逐渐加深 B. 气态氢化物的稳定性逐渐增强
C. 与氢气反应越来越容易 D. 单质的熔、沸点逐渐降低
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 L 1 mol·L-1的K2SO4溶液中含有2 mol K+
B. H2SO4的摩尔质量为98
C. 标准状况下,22.4 L H2O中含有NA个氧原子
D. 18 g T2O中含有NA个氧原子
难度: 中等查看答案及解析
-
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是( )
A. 气态氢化物的酸性:HX>H2Y>ZH3
B. 非金属活泼性:Y<X<Z
C. 原子半径:X>Y>Z
D. 与H2化合的剧烈程度:X>Y>Z
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加BaCl2溶液,有白色沉淀生成,加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42-
B
向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体
该溶液中一定含有CO32-
D
向某溶液加NaOH并微热,产生能使湿润红色石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 铝与氢氧化钠溶液反应:2Al+2OH-══ 2AlO2-+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 二氧化硅与氢氧化钠溶液反应:SiO2+2OH- ══ SiO32- +H2O
D. 硅酸钠与盐酸反应:Na2SiO3 + 2H+ ══ H2SiO3↓ + 2Na+
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 碱金属与氧气化合生成的产物都属于碱性氧化物
B. K与水反应比Na与水反应更剧烈
C. 碱金属锂、钠、钾都可以保存在煤油中
D. 碱金属单质具有强还原性,形成的离子具有强氧化性
难度: 简单查看答案及解析
-
分离食用油和水简单可行的操作是( )
A. 蒸发 B. 分液 C. 过滤 D. 蒸馏
难度: 简单查看答案及解析
-
下列各组中,顺序排列错误的是( )
A. 离子半径:Na+>Mg2+>Al3+>F-
B. 酸性强弱:H2SiO3<H3PO4 <H2SO4<HClO4
C. 热稳定性:HCl>H2S>PH3>AsH3
D. 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
A. W的氧化物对应的水化物是强酸 B. 原子半径:X﹥Y
C. Z单质氧化性强于Y单质 D. X的氢化物的水溶液呈酸性
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A. 工艺师利用盐酸刻蚀石英制作艺术品
B. 过氧化钠可用于呼吸面具作为氧气的来源
C. 氧化铁常用作红色油漆和涂料
D. 常温下可用铁制或铝制容器盛装浓硫酸
难度: 简单查看答案及解析
-
如图是产生和收集气体的实验装置,该装置最适合于( )
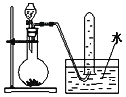
A. 用浓硝酸与 Cu反应制取 NO2
B. 用浓盐酸和MnO2反应制取C12
C. 用H2O2溶液和MnO2反应制取O2
D. 用NH4Cl和Ca(OH)2反应制取NH3
难度: 中等查看答案及解析
-
已知R元素的原子结构示意图如下图,下列说法正确的是
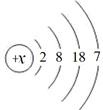
A. R元素的原子序数为36 B. R元素是第4周期元素
C. R元素的最高正化合价为+8 D. R元素的原子在反应中易失去电子
难度: 简单查看答案及解析
-
4Ag +2H2S +O2 == 2X +2H2O,下列有关该反应的说法正确的是( )
A. Ag得到电子 B. X为AgS
C. O2被还原 D. 每生成1molX转移电子数4NA
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入 NaOH溶液直至过量,产生沉淀的质量与加入的 NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
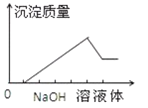
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有 Mg2+、Al3+
难度: 中等查看答案及解析