-
下列反应的离子方程式书写正确的是( )
A. H2SO4溶液与氨水反应:H++OH-===H2O
B. CuO与稀盐酸反应:CuO+2H+===Cu2++H2O
C. AlCl3溶液与氢氧化钠溶液反应:AlCl3+3OH-===Al(OH)3↓+3Cl-
D. Cl2与氢氧化钠溶液反应:Cl2+2OH-===2ClO-+H2O
难度: 简单查看答案及解析
-
江苏省已开始大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A. 将废旧电池深埋,防止污染环境
B. 加强城市生活污水脱氮除磷处理,遏制水体富营养化
C. 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D. 农作物秸秆收割后可发酵制造沼气和农家肥
难度: 简单查看答案及解析
-
对于反应中的能量变化,表述正确的是
A. 放热反应中,反应物的总能量大于生成物的总能量
B. 断开化学键的过程会放出能量
C. 加热才能发生的反应一定是吸热反应
D. 氧化反应均为吸热反应
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 氯化氢的电子式:
B. 氯离子的结构示意图:
C. 中子数为20的氯原子:2017Cl D. 碳酸钠的电离方程式:Na2CO3=Na2++CO32-
难度: 简单查看答案及解析
-
下列物质属于共价化合物的是
A. NaCl B. K2O C. CO D. N2
难度: 简单查看答案及解析
-
下列物质含有离子键的是
A. C12 B. MgF2 C. CO2 D. H2O
难度: 简单查看答案及解析
-
下列各组物质互为同分异构体的是
A. O2和O3 B. CH3CH2CH2CH3和CH(CH3)3
C. 12C和13C D. CH3和CH3CH3
难度: 中等查看答案及解析
-
实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率减慢的是
A. 向稀硫酸中加水 B. 增加锌粒的量
C. 用锌粉代替锌粒 D. 升高反应温度
难度: 中等查看答案及解析
-
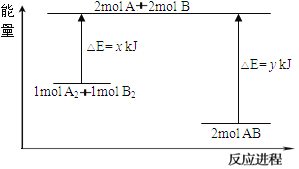
下列反应过程中的能量变化情况符合如图的是
A. 酸与碱的中和反应 B. 镁和盐酸的反应
C. 氧化钙和水反应 D. 水发生分解反应
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 原子半径:Al>Mg>Na>H
B. 热稳定性:NH3>PH3>H2S>HCl
C. 酸性:HClO4>H2SiO3>H3PO4>H2CO3
D. 元素非金属性:F>O>N>C
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2 C. NaCl和HCl D. CCl4和KCl
难度: 中等查看答案及解析
-
下列过程中化学键没有被破坏的是
A. 水降温结冰 B. 水电解得到氧气与氢气
C. 金刚石加热融化 D. NaOH溶于水
难度: 简单查看答案及解析
-
下列说法正确的是
A. 固态CH4与NH4Cl都属于分子晶体
B. MgCl2中既有离子键又有共价键
C. 冰融化时,分子中H-O键发生断裂
D. 熔沸点由高到低的顺序是:金刚石>NaCl>H2O
难度: 中等查看答案及解析
-
4NH3+5O2
4NO+6H2O是硝酸工业中的一个反应。下列关于该反应的说法正确的是( )
A. 增大反应物浓度能减慢反应速率 B. 降低温度能加快反应速率
C. 使用催化剂能加快反应速率 D. NH3与O2能100%转化为产物
难度: 简单查看答案及解析
-
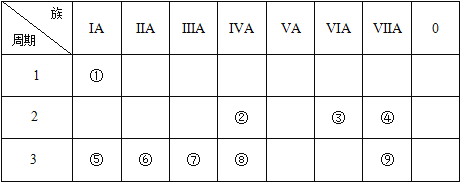
下列有关元素的性质及其递变规律正确的是
A. IA族与ⅦA族元素间可形成共价化合物或离子化合物
B. 第二周期元素从左到右,最高正价从+1递增到+7
C. 同主族元素从上到下金属性越来越弱
D. 同周期金属元素的最外层电子越多,其原子失电子能力越强
难度: 简单查看答案及解析
-
在含有大量OH-、Ba2+、Cl-的溶液中,还可能大量共存的离子是( )
A. H+ B. Ag+ C. NO
D. SO
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是
A. 2SO2 + O2=2SO3 △H=-196.6 kJ/mol
B. H2(g)+1/2O2(g)==H2O (g) △H=-241.8 kJ
C. 2H2(g)+O2(g)== 2H2O(l) △H=-571.6 kJ/mol
D. C(s) + O2(g)== CO2(g) △H= + 393.5 kJ/mol
难度: 简单查看答案及解析
-
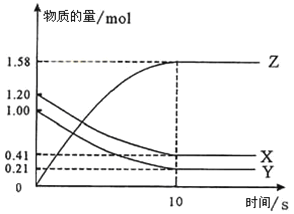
可逆反应:A+3B
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·s),②VB=0.6mol/(L·s),③VC=0.4mol/(L·s),④VD=0.45mol/(L·s),则以上四种情况下反应速率由小到大排列正确的是
A. ②>④>③>① B. ②>③=④>①
C. ④>②=③>① D. ④>③>②>①
难度: 简单查看答案及解析
-
某学生欲通过实验判断X,Y,Z,W四块金属的活泼性, 做了如下实验并得结论:当X,Y与稀硫酸组成原电池时,Y为负极;Z可以从水中置换出H2,W不能从水中置换出H2;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是
A. Z >X >W >Y B. Z >W >Y >X C. X >Y >W >Z D. X >Y >Z >W
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-,以下说法不正确的是
A. 负极发生的反应为:Fe-2e- = Fe2+
B. 正极发生的反应为:2H2O+O2+4e-= 4OH-
C. 铁在上述情况下发生的腐蚀称之为电化学腐蚀
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
难度: 中等查看答案及解析
-
我国已经成功研制出性能先进的铼镍合金单晶涡轮叶片冶炼铼(Re)的主要反应为:2NH4ReO4+ 7H2
2 Re + 2NH3 + 8H2O。下列说法正确的是
A. H2是氧化剂 B. H2发生还原反应
C. NH4ReO4在反应中得到电子 D. NH4ReO4在反应中被氧化
难度: 简单查看答案及解析
-
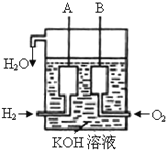
锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )
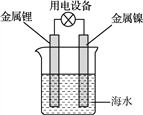
A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 海水作为电解质溶液
D. 可将电能转化为化学能
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为16。Y的单质是空气中含量最多的气体,Z原子的最外层电子数是其内层电子数的3倍,W是短周期中金属性最强的元素。下列说法正确的是
A. X位于元素周期表中第2周期ⅤA族 B. 原子半径:r(X)>r(Y)>r(Z)>r(W)
C. X、Y、Z的气态氢化物稳定性依次减弱 D. 由Z和W组成的化合物不止一种
难度: 中等查看答案及解析