-
下列设备工作时,将化学能转化为热能的是( )
A. 太阳能电池板
 B. 太阳能热水器
B. 太阳能热水器
C. 燃气灶
 D. 锂电池
D. 锂电池
难度: 简单查看答案及解析
-
黑火药是硫磺粉、硝石、木炭粉按一定比例混合而成(2KNO3+ S + 3C =K2S + N2↑+ 3CO2↑)。古文献《本草经集注》记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”。下列推断正确的是
A. “紫青烟”主要是指钠元素的焰色反应 B. “朴消”在灼烧时火焰没有颜色
C. “硝石”在黑火药中起还原剂的作用 D. “朴消”不能替代“硝石”制黑火药
难度: 中等查看答案及解析
-
“立刻凉”饮料在饮用时将饮料罐隔离层中的固体化学物质和水混合后摇动即会对饮料起到冷却作用。该化学物质可能是:
A. NaCl B. CaO C. NH4NO3 D. NaOH
难度: 简单查看答案及解析
-
科学家联合小组宣布合成出 114 号元素的一种同位素,该同位素原子的质量数为 298。以下叙述不正确的是( )
A. 该元素属于第七周期 B. 该元素为金属元素,性质与 82Pb 相同
C. 该元素位于第ⅣA 族 D. 该同位素原子含有 114 个电子,184 个中子
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A. 强酸性溶液中:NH4+、Al3+、HCO3-、Cl-
B. 与 Al 反应放出氢气的溶液中:Na+、Ca2+、Cl-、Mg2+
C. 0.1 mol·L-1FeCl3溶液中:Fe2+、NH4 +、NO3-、H+
D. 0.1 mol·L-1 NaAlO2溶液中:OH-、Na+、Cl-、SO4 2-
难度: 中等查看答案及解析
-
X、Y、Z、W 为短周期元素,X 的 M 电子层有 1 个电子,Y 是组成有机物的最基础的元素,Z 的最外层电子数比次外层少 2,Z 与 W 同周期,W 的原子半径小于 Z。下列有关说法正确的是
A. 原子半径:X<Y<Z<W
B. Z、W 均可与 Mg 形成离子化合物
C. 气态氢化物的稳定性:Y>Z>W
D. 最高价氧化物对应水化物的酸性:Z>W
难度: 中等查看答案及解析
-
下列有关化学用语的表示方法中错误的是
A. 次氯酸的电子式:
B. M2+离子核外有 a个电子,b个中子,M 原子符号为a+b+2a+2M
C. 用电子式表示MgCl2 的形成过程为

D. Na+的结构示意图:
难度: 中等查看答案及解析
-
应用元素周期律分析,下列推断正确的是
A. 砹(At)是第 VIIA 族元素,其氢化物的稳定性大于 HCl
B. 碳酸锶易溶于水,易与稀盐酸反应
C. 第 2 周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
D. 第 3 周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
难度: 中等查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体催化剂) 合成 NH3 的原理示意图,化学方程式为 2N2+6H2O=4NH3+3O2。下列说法不正确的是()
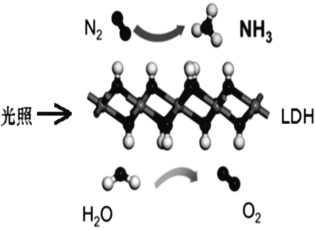
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及共价键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为 4∶3
D. 2molN2 与足量水充分反应,能制得氨气 4mol
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉, 最多能溶解 l9.2g(已知硝酸只被还原为 NO 气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法不正确的是( )
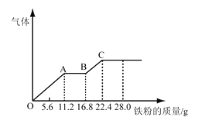
A. c 点时,溶液中的溶质为 FeSO4
B. oa 段发生反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
C. 原混和酸中稀硝酸的物质的量浓度为 2mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4mol/L
难度: 困难查看答案及解析